名校
解题方法
1 . 将CO2转化成C2H4可以变废为宝、改善环境。以CO2、C2H6为原料合成C2H4涉及的主要反应如下:
Ⅰ.CO2(g) + C2H6(g) C2H4(g)+H2O(g)+CO(g) ∆H = +177 kJ·mol-1(主反应)
C2H4(g)+H2O(g)+CO(g) ∆H = +177 kJ·mol-1(主反应)
Ⅱ.C2H6(g) CH4(g)+H2(g)+C(s) ∆H = +9kJ·mol-1 (副反应)
CH4(g)+H2(g)+C(s) ∆H = +9kJ·mol-1 (副反应)
(1)反应I的反应历程可分为如下两步:
i.C2H6(g) C2H4(g)+H2(g) ∆H1 = +136 kJ·mol-1(反应速率较快)
C2H4(g)+H2(g) ∆H1 = +136 kJ·mol-1(反应速率较快)
ii.H2(g)+CO2(g) H2O(g)+CO(g) ∆H2 (反应速率较慢)
H2O(g)+CO(g) ∆H2 (反应速率较慢)
①∆H2 =______ kJ·mol-1
②相比于提高c(C2H6),提高c(CO2) 对反应I速率影响更大,原因是______ 。
(2)0.1 MPa时向密闭容器中充入CO2和C2H6,温度对催化剂K-Fe-Mn/Si-2 性能的影响如图所示:
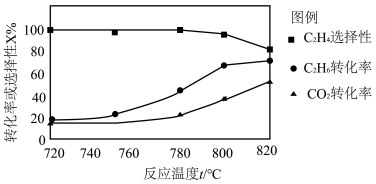
① 工业生产中反应I选择800℃,原因是______ 。
② 800℃时,不同的CO2和C2H6体积比对反应影响的实验数据如下表:
a. 随 增大, CO2转化率将
增大, CO2转化率将______ (填“增大”或“减小”)。
b. 解释 对产物中C2H4的质量分数影响的原因:
对产物中C2H4的质量分数影响的原因:______ 。
(3)我国科学家使用电化学的方法(装置如图)

用C2H6 和CO2合成了C2H4。
①N是电源的______ 极。
②阳极电极反应式是______ 。
Ⅰ.CO2(g) + C2H6(g)
 C2H4(g)+H2O(g)+CO(g) ∆H = +177 kJ·mol-1(主反应)
C2H4(g)+H2O(g)+CO(g) ∆H = +177 kJ·mol-1(主反应)Ⅱ.C2H6(g)
 CH4(g)+H2(g)+C(s) ∆H = +9kJ·mol-1 (副反应)
CH4(g)+H2(g)+C(s) ∆H = +9kJ·mol-1 (副反应)(1)反应I的反应历程可分为如下两步:
i.C2H6(g)
 C2H4(g)+H2(g) ∆H1 = +136 kJ·mol-1(反应速率较快)
C2H4(g)+H2(g) ∆H1 = +136 kJ·mol-1(反应速率较快)ii.H2(g)+CO2(g)
 H2O(g)+CO(g) ∆H2 (反应速率较慢)
H2O(g)+CO(g) ∆H2 (反应速率较慢)①∆H2 =
②相比于提高c(C2H6),提高c(CO2) 对反应I速率影响更大,原因是
(2)0.1 MPa时向密闭容器中充入CO2和C2H6,温度对催化剂K-Fe-Mn/Si-2 性能的影响如图所示:

① 工业生产中反应I选择800℃,原因是
② 800℃时,不同的CO2和C2H6体积比对反应影响的实验数据如下表:
 | 平衡时有机产物的质量分数 | |
| CH4 | C2H4 | |
| 15.0/15.0 | 7.7 | 92.3 |
| 20.0/10.0 | 6.4 | 93.6 |
| 24.0 /6.0 | 4.5 | 95.5 |
 增大, CO2转化率将
增大, CO2转化率将b. 解释
 对产物中C2H4的质量分数影响的原因:
对产物中C2H4的质量分数影响的原因:(3)我国科学家使用电化学的方法(装置如图)

用C2H6 和CO2合成了C2H4。
①N是电源的
②阳极电极反应式是
您最近一年使用:0次
2020-11-09更新
|
274次组卷
|
4卷引用:北京市朝阳区2021届高三上学期期中质量检测化学试题
2 . 碳及其化合物与人类生产、 生活密切相关。请回答下列问题:
(1)羰基硫(O=C=S) 能引起催化剂中毒和大气污染等。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应原理为:
①氢解反应: COS(g)+H2(B) H2S(g)+CO(g) △H1
H2S(g)+CO(g) △H1
②水解反应: COS(g)+H2O(g) H2S(g)+CO2(g) △H2=-35 kJ·mol-1
H2S(g)+CO2(g) △H2=-35 kJ·mol-1
已知CO(g)+H2O(g) H2(g)+CO2(g) △H3=-42kJ·mol-1,则△H1=
H2(g)+CO2(g) △H3=-42kJ·mol-1,则△H1=______ ,羰基硫氢解反应_________ (填“能”或“示能”) 设计成原电池。若平衡常数K 与温度T之间存在1gK=a/T+b (a、b为常数) 的线性关系,图中直线符合该氢解反应平衡常数K与温度T关系的是_________ (填字母)。

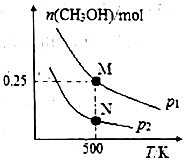
(2)CO 可以合成甲醇 CO(g)+2H2(g) CH3OH(g)。在体积可变的密闭容器中投入1molCO和2.5molH2,在不同条件下发生反应。实验测得平衡时CH3OH的物质的量随温度、压强变化如图所示。M点时,H2的转化率为
CH3OH(g)。在体积可变的密闭容器中投入1molCO和2.5molH2,在不同条件下发生反应。实验测得平衡时CH3OH的物质的量随温度、压强变化如图所示。M点时,H2的转化率为_________ ;反应速率N 点v 正(CO)_________ M 点v逆(CO) (填“>”“<”或“=”)。
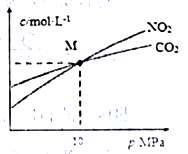
(3)焦炭还原NO2 发生反应2NO2(g)+2C(s) N2(g)+2CO2(g)。在恒温条件下,1molNO2 和足量焦炭发生该反应,测得平衡时NO2利CO2的物质的量浓度与平衡总压的关系如图所示,计算可得M点时该反应的平衡常数Kp(M)=
N2(g)+2CO2(g)。在恒温条件下,1molNO2 和足量焦炭发生该反应,测得平衡时NO2利CO2的物质的量浓度与平衡总压的关系如图所示,计算可得M点时该反应的平衡常数Kp(M)=_________ (Kp是用平衡分压代替平衡浓度表达反应的平衡常数,分压=总压×物质的量分数)。
(4)常温下,用氨水吸收CO2得到NH4HCO3溶液。在NH4HCO3 溶液中c(NH4+)________ c(HCO3-)(填“>”“<”或“=”)
。反应NH4++HCO3-+ H2O NH3· H2O +H2CO3 的平衡常数K=
NH3· H2O +H2CO3 的平衡常数K=_________ 。(已知常温下H2CO3的Ka1=4×10-7mol·L-1,Ka2=4×10-11 mol·L-1,NH3·H2O 的Kb=2×10-5mol·L-1)
(1)羰基硫(O=C=S) 能引起催化剂中毒和大气污染等。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应原理为:
①氢解反应: COS(g)+H2(B)
 H2S(g)+CO(g) △H1
H2S(g)+CO(g) △H1②水解反应: COS(g)+H2O(g)
 H2S(g)+CO2(g) △H2=-35 kJ·mol-1
H2S(g)+CO2(g) △H2=-35 kJ·mol-1已知CO(g)+H2O(g)
 H2(g)+CO2(g) △H3=-42kJ·mol-1,则△H1=
H2(g)+CO2(g) △H3=-42kJ·mol-1,则△H1=
(2)CO 可以合成甲醇 CO(g)+2H2(g)
 CH3OH(g)。在体积可变的密闭容器中投入1molCO和2.5molH2,在不同条件下发生反应。实验测得平衡时CH3OH的物质的量随温度、压强变化如图所示。M点时,H2的转化率为
CH3OH(g)。在体积可变的密闭容器中投入1molCO和2.5molH2,在不同条件下发生反应。实验测得平衡时CH3OH的物质的量随温度、压强变化如图所示。M点时,H2的转化率为
(3)焦炭还原NO2 发生反应2NO2(g)+2C(s)
 N2(g)+2CO2(g)。在恒温条件下,1molNO2 和足量焦炭发生该反应,测得平衡时NO2利CO2的物质的量浓度与平衡总压的关系如图所示,计算可得M点时该反应的平衡常数Kp(M)=
N2(g)+2CO2(g)。在恒温条件下,1molNO2 和足量焦炭发生该反应,测得平衡时NO2利CO2的物质的量浓度与平衡总压的关系如图所示,计算可得M点时该反应的平衡常数Kp(M)=
(4)常温下,用氨水吸收CO2得到NH4HCO3溶液。在NH4HCO3 溶液中c(NH4+)
。反应NH4++HCO3-+ H2O
 NH3· H2O +H2CO3 的平衡常数K=
NH3· H2O +H2CO3 的平衡常数K=
您最近一年使用:0次
3 . CO2是一种常用的化工原料。
Ⅰ.以CO2与NH3为原料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)。
CO(NH2)2(s)+H2O(g)。
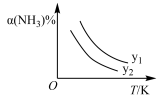
(1)在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率变化情况如图所示。该反应的ΔH_____ 0(填“>”、“<”或“=”,下同),若y表示压强,则y1_______ y2 , 若y表示反应开始时的水碳比[n(NH3)/n(CO2)],则y1_______ y2。
(2)t℃时,若向容积为2L的密闭容器中加入3molNH3和1molCO2,达到平衡时,容器内压强为开始时的0.75倍。若保持条件不变,再向该容器中加入0.5molCO2和1molH2O,NH3的转化率将__________ (填“增大”、“减小”或“不变”)。
Ⅱ.CO2与H2反应可用于生产甲醇。
(3)已知氢气与甲醇的燃烧热分别为-285.8 kJ·mol-1、-726.5kJ·mol-1,则CO2与H2反应产生液态甲醇与液态水的热化学方程式为________________ 。
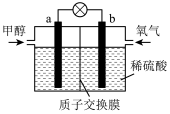
(4)下图是某甲醇燃料电池工作的示意图。质子交换膜(只有质子能够通过)左右两侧的溶液均为1L 2mol·L-1 H2SO4溶液。电极a上发生的电极反应式为________________________ ,当电池中有1mol e-发生转移时左右两侧溶液的质量之差为______ g (假设反应物耗尽,忽略气体的溶解)。
Ⅰ.以CO2与NH3为原料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g)。
CO(NH2)2(s)+H2O(g)。 (1)在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率变化情况如图所示。该反应的ΔH

(2)t℃时,若向容积为2L的密闭容器中加入3molNH3和1molCO2,达到平衡时,容器内压强为开始时的0.75倍。若保持条件不变,再向该容器中加入0.5molCO2和1molH2O,NH3的转化率将
Ⅱ.CO2与H2反应可用于生产甲醇。
(3)已知氢气与甲醇的燃烧热分别为-285.8 kJ·mol-1、-726.5kJ·mol-1,则CO2与H2反应产生液态甲醇与液态水的热化学方程式为
(4)下图是某甲醇燃料电池工作的示意图。质子交换膜(只有质子能够通过)左右两侧的溶液均为1L 2mol·L-1 H2SO4溶液。电极a上发生的电极反应式为

您最近一年使用:0次
2019-02-20更新
|
136次组卷
|
2卷引用:福建省泉州市泉港区第一中学2018-2019学年高二上学期期末考试化学试题



