名校
1 . 下列实验方案的设计能达到目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 探究增大压强,平衡逆向移动 | 其他条件不变,缩小H2(g)+I2(g) 2HI(g)的平衡体系的容器容积,气体颜色变深 2HI(g)的平衡体系的容器容积,气体颜色变深 |
| B | 取20.00mL盐酸 | 在50mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸放入锥形瓶 |
| C | 探究温度对化学平衡的影响 | 把装有颜色相同的NO2和N2O4混合气的两支试管(密封)分别浸入冷水和热水中 |
| D | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液直接加热蒸干 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 甲醇、乙醇都可用作涂料、染料的化工原料,也可用作燃料。
I.工业上,在一定条件下可用乙烯气相水化法制备乙醇。其反应为:CH2=CH2(g)+H2O(g)=H3CH2OH(g) △H。
已知:①CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(g) △H1=-1323kJ·mol-1
②CH3CH2OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H2=-1289kJ·mol-1
(1)CH2=CH2(g)+H2O(g)=CH3CH2OH(g)反应的的活化能Ea(正)为102kJ·mol-1,则该反应的活化能Ea(逆)为_______ kJ∙mol-1。
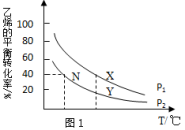
(2)在密闭容器中充入CH2=CH2(g)、H2O(g)(两者物质的量之比为1:1)并加入催化剂发生反应,乙烯的平衡转化率与温度、压强的关系如图1所示。p1_______ p2(填“>”或“<”,下同),X、Y两点的速率v(X)_______ v(Y),试用碰撞理论解释:_______ 。
II.在一定条件下可用CO与H2合成甲醇。
(3)已知反应CO(g)+2H2(g)⇌CH3OH(g),一定温度下,向2L密闭容器中通2molCO和2molH2测得平衡时甲醇物质的量随时间关系变化如表所示。
①10~20min内,用CO表示的平均反应速率是_______ 。
②若起始压强为p0 Pa,则平衡时的平衡常数Kp=_______ (用含p0的代数式表示)。[用平衡分压p总代替平衡浓度计算。已知:气体分压(p分)=气体总压(p总)×物质的量分数]
(4)以稀硫酸为电解质,由甲醇、O2构成的原电池(图2)作电解饱和食盐水(图3)的电源。
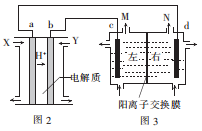
①图3装置中溶液中阳离子由_______ (填"左向右"或"右向左")移动。
②a电极的电极反应式为:_______ 。
I.工业上,在一定条件下可用乙烯气相水化法制备乙醇。其反应为:CH2=CH2(g)+H2O(g)=H3CH2OH(g) △H。
已知:①CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(g) △H1=-1323kJ·mol-1
②CH3CH2OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H2=-1289kJ·mol-1
(1)CH2=CH2(g)+H2O(g)=CH3CH2OH(g)反应的的活化能Ea(正)为102kJ·mol-1,则该反应的活化能Ea(逆)为
(2)在密闭容器中充入CH2=CH2(g)、H2O(g)(两者物质的量之比为1:1)并加入催化剂发生反应,乙烯的平衡转化率与温度、压强的关系如图1所示。p1

II.在一定条件下可用CO与H2合成甲醇。
(3)已知反应CO(g)+2H2(g)⇌CH3OH(g),一定温度下,向2L密闭容器中通2molCO和2molH2测得平衡时甲醇物质的量随时间关系变化如表所示。
时间/min | 10 | 20 | 30 | 40 | |
CH3OH的物质的量/mol | 0.4 | 0.7 | 0.8 | 0.8 |
①10~20min内,用CO表示的平均反应速率是
②若起始压强为p0 Pa,则平衡时的平衡常数Kp=
(4)以稀硫酸为电解质,由甲醇、O2构成的原电池(图2)作电解饱和食盐水(图3)的电源。

①图3装置中溶液中阳离子由
②a电极的电极反应式为:
您最近一年使用:0次



