11-12高二下·云南昆明·期末
名校
1 . 下列说法正确的是
| A.在一定温度下AgCl水溶液中Ag+和Cl-浓度的乘积是一个常数 |
| B.AgCl水溶液的导电性很弱,所以AgCl为弱电解质 |
| C.温度一定时,当AgCl水溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液 |
| D.向饱和AgCl水溶液中加入盐酸,c(Cl-)增大,Ksp值变大 |
您最近一年使用:0次
2016-12-09更新
|
389次组卷
|
3卷引用:2016-2017学年湖南省湘潭县第一中学高二上学期期末考试化学试卷
11-12高二上·湖南·期中
2 . 下列说法不正确的是__________。
| A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小; |
| B.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。 |
C.对于Al(OH)3(s) Al(OH)3(aq) Al(OH)3(aq)  Al3++3OH-,前者为溶解平衡,后者为电离平衡; Al3++3OH-,前者为溶解平衡,后者为电离平衡; |
| D.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大 |
您最近一年使用:0次
11-12高二上·山东济宁·阶段练习
名校
3 . 下列有关沉淀溶解平衡的说法正确的是( )
| A.Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度 |
| B.在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的Ksp增大 |
| C.在氯化银的沉淀溶解平衡体系中加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀 |
| D.在碳酸钙的沉淀溶解平衡体系中,通入CO2气体,溶解平衡不移动 |
您最近一年使用:0次
2016-12-09更新
|
491次组卷
|
5卷引用:2019年湖南省怀化市高三化上学期期末考试化学试题
2019年湖南省怀化市高三化上学期期末考试化学试题(已下线)2011-2012学年山东省济宁汶上一中高二12月月考化学试卷(已下线)2012届黑龙江省大庆铁人中学高三期末考试化学试卷山西省朔州市应县第一中学2017-2018学年高二上学期月考(四)化学试题河南省安阳市第二中学2018-2019学年高二上学期期中考试化学试题
10-11高二下·浙江金华·期中
4 . 下列说法正确的是
| A.pH=7的溶液一定是中性溶液 |
| B.能自发进行的化学反应,不一定是△H<0、△S>0 |
| C.白色污染、绿色食品中的“白”“绿”均指相关物质的颜色 |
| D.Ksp不仅与难溶电解质的性质和温度有关,而且与溶液中的离子浓度有关 |
您最近一年使用:0次
5 . 请按要求回答下列问题:
(1)将100mL 0.3mol·L-1的NaHSO4溶液和100mL 0.2mol·L-1的Ba(OH)2溶液充分混合,写出所发生反应的离子方程式:____________________________ ;
若向反应后的溶液中滴加2-3滴酚酞试液,则溶液的颜色变为__________________ ;
(2)某温度时,水的离子积常数KW=10-13,将此温度下pH=11的Ba(OH)2溶液aL与pH=1的H2SO4溶液bL混合,设混合溶液体积为两者之和,所得固体体积忽略不计。若所得混合溶液为中性,则a:b=_________________
(3)已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)=1.8×10-10,Ksp(AgY)=1.0×10-12,Ksp(AgZ)=8.7×10-17。则AgX、AgY、AgZ三者的溶解度(mol/L)S(AgX)、S(AgY)、S(AgZ)的大小顺序为:____________________________ ;若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)________ (填“增大”“减小”或“不变”)。
(1)将100mL 0.3mol·L-1的NaHSO4溶液和100mL 0.2mol·L-1的Ba(OH)2溶液充分混合,写出所发生反应的离子方程式:
若向反应后的溶液中滴加2-3滴酚酞试液,则溶液的颜色变为
(2)某温度时,水的离子积常数KW=10-13,将此温度下pH=11的Ba(OH)2溶液aL与pH=1的H2SO4溶液bL混合,设混合溶液体积为两者之和,所得固体体积忽略不计。若所得混合溶液为中性,则a:b=
(3)已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)=1.8×10-10,Ksp(AgY)=1.0×10-12,Ksp(AgZ)=8.7×10-17。则AgX、AgY、AgZ三者的溶解度(mol/L)S(AgX)、S(AgY)、S(AgZ)的大小顺序为:
您最近一年使用:0次
6 . 酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
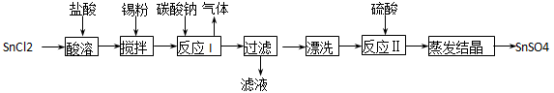
回答下列问题:
(1) SnCl2用盐酸而不用水直接溶解的原因是:_______________ ;加入锡粉的作用是:_______________ ;
(2) 反应I生成的沉淀为SnO,写出该反应的化学方程式:_______________ ;
(3) 检验沉淀已经“洗涤”干净的操作是:______________________________ ;
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH。若溶液中c(Sn2+)=1.0mol·L-1,则室温下应控制溶液pH_______________ 。(已知:Ksp[Sn (OH)2]=1.0×10-26)
(5)酸性条件下,SnSO4还可用作双氧水的去除剂,试写出所发生反应的离子方程式:_______________ 。

回答下列问题:
(1) SnCl2用盐酸而不用水直接溶解的原因是:
(2) 反应I生成的沉淀为SnO,写出该反应的化学方程式:
(3) 检验沉淀已经“洗涤”干净的操作是:
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH。若溶液中c(Sn2+)=1.0mol·L-1,则室温下应控制溶液pH
(5)酸性条件下,SnSO4还可用作双氧水的去除剂,试写出所发生反应的离子方程式:
您最近一年使用:0次
2016-12-09更新
|
185次组卷
|
4卷引用:2016届湖南省株洲市第二中学高三上学期期中化学试卷
2016届湖南省株洲市第二中学高三上学期期中化学试卷(已下线)2012届江苏省苏中三市高三5月第二次调研测试化学试卷(已下线) 2012届江苏省苏中三市高三5月第二次调研测试化学试卷 江苏省镇江市吕叔湘中学2021届高三上学期11月教学调研化学试题
10-11高三上·湖南娄底·阶段练习
7 . 氢氧化镁固体在水中溶解,有下列平衡:Mg(OH)2(s)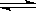 Mg2++ 2OH―,加入下列哪种固体物质可使Mg(OH)2固体的质量减少
Mg2++ 2OH―,加入下列哪种固体物质可使Mg(OH)2固体的质量减少
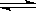 Mg2++ 2OH―,加入下列哪种固体物质可使Mg(OH)2固体的质量减少
Mg2++ 2OH―,加入下列哪种固体物质可使Mg(OH)2固体的质量减少| A.Na2CO3 | B.MgCl2 | C.NH4Cl | D.NaCl |
您最近一年使用:0次
名校
8 . 连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为_____________________ 。
(2)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
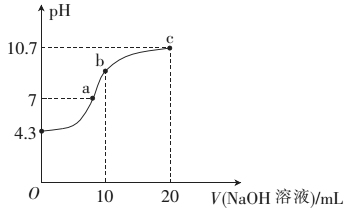
①写出H2N2O2在水溶液中的电离方程式:______________ 。
②b点时溶液中c(H2N2O2)_____ (填“>”、“<”或 “=”,下同)c(N2O22-)。
③a点时溶液中c(Na+)____ c(HN2O2-)+c(N2O22-)。
(3)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中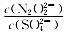 =
=______ 。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
(1)连二次硝酸中氮元素的化合价为
(2)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。

①写出H2N2O2在水溶液中的电离方程式:
②b点时溶液中c(H2N2O2)
③a点时溶液中c(Na+)
(3)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中
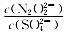 =
=
您最近一年使用:0次
2016-12-09更新
|
814次组卷
|
4卷引用:湖南省长沙浏阳市2019-2020学年高二上学期期末考试化学试题(高考类)
10-11高二上·湖南·阶段练习
9 . 已知某氢氧化物 的溶度积常数为
的溶度积常数为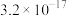 ,则
,则 在水中的溶解度为:
在水中的溶解度为:
 的溶度积常数为
的溶度积常数为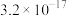 ,则
,则 在水中的溶解度为:
在水中的溶解度为:A. | B. |
C. | D. |
您最近一年使用:0次
10 . 碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:

(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是________________ 。
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol·L-1,调节pH的范围是________________ 。
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式:__________________ 。
(4)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·yNi(OH)2。现称取9.18 g样品溶于稀硫酸,加入100 mL 1.0 mol·L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200 mL。取出20.00 mL,用0.010 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定x、y的值(写出计算过程)。涉及反应如下(均未配平):
NiOOH+Fe2++H+—Ni2++Fe3++H2O Fe2++MnO4-+H+—Fe3++Mn2++H2O
____________________________

(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol·L-1,调节pH的范围是
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式:
(4)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·yNi(OH)2。现称取9.18 g样品溶于稀硫酸,加入100 mL 1.0 mol·L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200 mL。取出20.00 mL,用0.010 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定x、y的值(写出计算过程)。涉及反应如下(均未配平):
NiOOH+Fe2++H+—Ni2++Fe3++H2O Fe2++MnO4-+H+—Fe3++Mn2++H2O
您最近一年使用:0次
2016-12-09更新
|
404次组卷
|
4卷引用:2016届湖南省师范大学附属中学高三上月考化学试卷



