1 . 回答下列问题:
(1)25℃时,CH3COOH的电离平衡常数为:K=1.8×10-5,H3PO3的电离平衡常数为:K1=8.3×10-3、K2=5.6×10-6;则:
①写出CH3COOH的电离方程式:___________
②25℃时,0.02mol/L的CH3COOH溶液的电离度约为______ %。
③往Na2HPO3溶液中滴加足量CH3COOH溶液的离子反应方程式为:____________
(2)①某课外活动小组为了探究BaSO4的溶解度,分别将足量BaSO4加入下列物质中:
a.5 mL水 b.40mL 0. 2 mol·L-1的Ba(OH)2溶液
c.20mL 0.5 mol·L-1的Na2SO4溶液 d.40mL 0.1 mol·L-1的H2SO4溶液中
溶解BaSO4后形成的溶液中,Ba2+的浓度由大到小的顺序为_____ (填字母)。
A.b>a>c>d B.b>a>d>c C.a>d>c>b D.a>b>d>c
②已知298K时,Ksp(BaSO4)=1.1×10-10,此时,溶液b中加入BaSO4固体后,c( )为
)为______________ mol·L-1。
(3)新型高效的乙烷燃料电池采用铂为电极材料,两电极上分别通入C2H6和O2 ,电解质溶液为KOH溶液。
①请写出乙烷燃料电池的负极反应式:_______________ 。
②利用此乙烷燃料电池给铅蓄电池充电,若充电过程中有3.0g乙烷完全反应,且不考虑能量损耗,则此充电过程消耗的O2在标况下的体积为_________ L(保留3位有效数字)、铅蓄电池的阳极质量减小________ g(保留3位有效数字)。
(1)25℃时,CH3COOH的电离平衡常数为:K=1.8×10-5,H3PO3的电离平衡常数为:K1=8.3×10-3、K2=5.6×10-6;则:
①写出CH3COOH的电离方程式:
②25℃时,0.02mol/L的CH3COOH溶液的电离度约为
③往Na2HPO3溶液中滴加足量CH3COOH溶液的离子反应方程式为:
(2)①某课外活动小组为了探究BaSO4的溶解度,分别将足量BaSO4加入下列物质中:
a.5 mL水 b.40mL 0. 2 mol·L-1的Ba(OH)2溶液
c.20mL 0.5 mol·L-1的Na2SO4溶液 d.40mL 0.1 mol·L-1的H2SO4溶液中
溶解BaSO4后形成的溶液中,Ba2+的浓度由大到小的顺序为
A.b>a>c>d B.b>a>d>c C.a>d>c>b D.a>b>d>c
②已知298K时,Ksp(BaSO4)=1.1×10-10,此时,溶液b中加入BaSO4固体后,c(
 )为
)为(3)新型高效的乙烷燃料电池采用铂为电极材料,两电极上分别通入C2H6和O2 ,电解质溶液为KOH溶液。
①请写出乙烷燃料电池的负极反应式:
②利用此乙烷燃料电池给铅蓄电池充电,若充电过程中有3.0g乙烷完全反应,且不考虑能量损耗,则此充电过程消耗的O2在标况下的体积为
您最近一年使用:0次
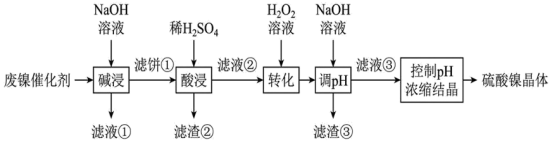
2 . 某油脂厂废弃的油脂加氢镍催化剂主要含金属 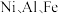 及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体
及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体 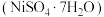 :
: 如表所示:
如表所示:
回答下列问题:
(1)“滤液②”中除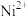 外还含有的金属离子
外还含有的金属离子___________ ;
(2)“转化”中可替代 的物质是
的物质是___________ (不能引入新的杂质离子);
由表格中的数据可求得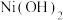 的
的 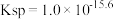 。如果“转化”后的溶液中
。如果“转化”后的溶液中 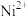 浓度为
浓度为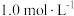 ,则除去杂质金属阳离子时“调
,则除去杂质金属阳离子时“调 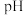 ”应控制的
”应控制的  范围是
范围是___________ 。
(3)硫酸镍在强碱溶液中用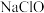 氧化,可沉淀出能用作镍镉电池正极材料的
氧化,可沉淀出能用作镍镉电池正极材料的 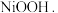 写出该反应的离子方程式
写出该反应的离子方程式___________ 。
(4)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是___________ 。
(5)第Ⅷ族元素单质及其化合物在工业生产和科研领域有重要的用途。
①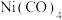 (该物质是配位化合物,且
(该物质是配位化合物,且  的结构式为
的结构式为  )常用作制备高纯镍粉,其熔点为
)常用作制备高纯镍粉,其熔点为 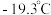 ,沸点为
,沸点为 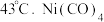 中
中  键和
键和  键的数目之比为
键的数目之比为___________ 。
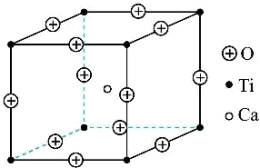
②在高温超导领域中,有一种化合物叫钙钛矿,其晶胞如图所示,在该晶胞中氧、钙、钛的粒子个数比是___________ 。
 及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体
及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体  :
:
 如表所示:
如表所示:| 金属离子 | 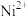 |  | 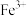 | 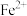 |
开始沉淀时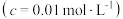 的  | 7.2 | 3.7 | 2.2 | 7.5 |
完全沉淀时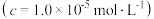 的  | 8.7 | 4.7 | 3.2 | 9.0 |
(1)“滤液②”中除
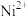 外还含有的金属离子
外还含有的金属离子(2)“转化”中可替代
 的物质是
的物质是由表格中的数据可求得
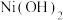 的
的 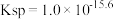 。如果“转化”后的溶液中
。如果“转化”后的溶液中 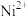 浓度为
浓度为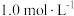 ,则除去杂质金属阳离子时“调
,则除去杂质金属阳离子时“调 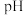 ”应控制的
”应控制的  范围是
范围是(3)硫酸镍在强碱溶液中用
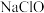 氧化,可沉淀出能用作镍镉电池正极材料的
氧化,可沉淀出能用作镍镉电池正极材料的 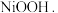 写出该反应的离子方程式
写出该反应的离子方程式(4)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是
(5)第Ⅷ族元素单质及其化合物在工业生产和科研领域有重要的用途。
①
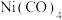 (该物质是配位化合物,且
(该物质是配位化合物,且  的结构式为
的结构式为  )常用作制备高纯镍粉,其熔点为
)常用作制备高纯镍粉,其熔点为 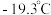 ,沸点为
,沸点为 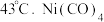 中
中  键和
键和  键的数目之比为
键的数目之比为②在高温超导领域中,有一种化合物叫钙钛矿,其晶胞如图所示,在该晶胞中氧、钙、钛的粒子个数比是
您最近一年使用:0次
解题方法
3 . 下列实验方案能达到实验目的的是

A.方案甲可制取无水 | B.方案乙可除去 溶液中部分的 溶液中部分的 |
C.方案丙可验证非金属性: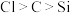 | D.方案丁可判断溶度积: |
您最近一年使用:0次
名校
4 . 绿矾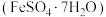 主要用于净水、照相制版及治疗缺铁性贫血等。工业上利用生活废铁(主要成分为
主要用于净水、照相制版及治疗缺铁性贫血等。工业上利用生活废铁(主要成分为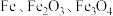 ,以及少量
,以及少量 等)制备绿矾的一种工艺流程如下:
等)制备绿矾的一种工艺流程如下:
(1)“焙烧”的目的是______ 。
(2)提高“酸溶”反应速率的措施是______ (任写一条)。“反应”时发生反应的离子方程式为______ 。
(3)隔绝空气的目的是______ ;一系列操作包括______ 、干燥。
(4)“酸溶”后,若溶液中 为
为 ,为了减少损失,常温下必须控制溶液的
,为了减少损失,常温下必须控制溶液的 小于
小于______  已知:
已知: 。
。
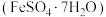 主要用于净水、照相制版及治疗缺铁性贫血等。工业上利用生活废铁(主要成分为
主要用于净水、照相制版及治疗缺铁性贫血等。工业上利用生活废铁(主要成分为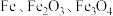 ,以及少量
,以及少量 等)制备绿矾的一种工艺流程如下:
等)制备绿矾的一种工艺流程如下: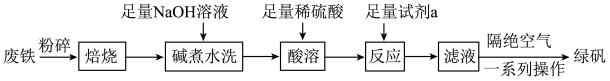
(1)“焙烧”的目的是
(2)提高“酸溶”反应速率的措施是
(3)隔绝空气的目的是
(4)“酸溶”后,若溶液中
 为
为 ,为了减少损失,常温下必须控制溶液的
,为了减少损失,常温下必须控制溶液的 小于
小于 已知:
已知: 。
。
您最近一年使用:0次
5 . 回答下列问题:
(1)某温度下,向含有AgCl固体的AgCl饱和溶液中加入少量稀盐酸,则AgCl的溶解度______ (填增大,减小或不变,下同),Ksp______ ,c(Ag+)______ 。
(2)现有25℃0.1mol/L的氨水。请回答以下问题:
①若向氨水中加入氯化铵固体,此时溶液中NH3•H2O电离程度_______ (填“增大”、“减小”或“不变”);此时溶液中水的离子积约等于_______ 。
②若向氨水中加入稀硫酸,使其恰好中和,写出离子方程式:______ 所得溶液的pH______ 7(填“>”“=”或“<”),用离子方程式表示其原因:______ 。
(1)某温度下,向含有AgCl固体的AgCl饱和溶液中加入少量稀盐酸,则AgCl的溶解度
(2)现有25℃0.1mol/L的氨水。请回答以下问题:
①若向氨水中加入氯化铵固体,此时溶液中NH3•H2O电离程度
②若向氨水中加入稀硫酸,使其恰好中和,写出离子方程式:
您最近一年使用:0次
解题方法
6 . 高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含Fe2+、Mn2+、Cu2+、Ni2+、Cd2+等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
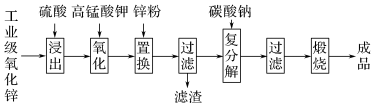
已知Ksp[Fe(OH)3]=8.0×10-38,回答下列问题:
(1)浸出时,为了提高浸出效率可采用的措施有(写一种既可)
(2)浸出步骤中发生主要反应的离子方程式为
(3)氧化时,加入KMnO4溶液是为了除去浸出液中的Fe2+和Mn2+(溶液中Mn全部转化为MnO2),请配平下列除去Fe2+的离子方程式:
□ +□Fe2++□___________=□MnO2↓+□Fe(OH)3↓+□H+
+□Fe2++□___________=□MnO2↓+□Fe(OH)3↓+□H+
(4)加入锌粉的目的是调节溶液pH除去Fe3+,和还原除去溶液中的
(5)已知H2SO4浸出液中,c(Fe2+)=50.4mg·L-1、c(Mn2+)=16.5mg·L-1,若要除尽1m3上述浸出液中的Fe2+和Mn2+,需加入
(6)若用酸性KMnO4标准溶液测定未知溶液中所含Fe2+的物质的量浓度(不含其他还原性粒子,MnO
 转化为Mn2+),不需要选取其他的指示剂,则滴定终点判断依据是
转化为Mn2+),不需要选取其他的指示剂,则滴定终点判断依据是
您最近一年使用:0次
7 . 氟化学在现代无机化学中占有相当重要的地位。
(1)1670年,德国人斯瓦恩哈德无意中将萤石( )与浓硫酸1∶1混合在一起,产生了一种刺激性气体,这种气体能腐蚀玻璃。该气体腐蚀玻璃的化学反应方程式为
)与浓硫酸1∶1混合在一起,产生了一种刺激性气体,这种气体能腐蚀玻璃。该气体腐蚀玻璃的化学反应方程式为___________ 。
(2)单质氟的制备是化学史上一段悲壮的历史,直到1886年法国化学家莫瓦桑电解熔融的氟化氢钾(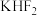 )才制得单质氟。电解过程中,两极均有气体产生,阴极的电极反应式为
)才制得单质氟。电解过程中,两极均有气体产生,阴极的电极反应式为___________ 。
(3)氟单质的反应性非常强,可与稀有气体氙发生反应。已知:
分压=总压×该组分物质的量分数,对于反应
 ,其中
,其中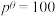 kPa,
kPa, 、
、 、
、 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。
下图是以0.125 mol/L Xe和1.225 mol/L 为起始量,得到的生成物在平衡体系中的分压与反应温度的关系。
为起始量,得到的生成物在平衡体系中的分压与反应温度的关系。
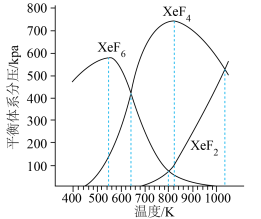
①制备 的适宜温度约为
的适宜温度约为___________ K。
②523K时,以Xe和 制取
制取 。反应达到平衡时,欲使产物中
。反应达到平衡时,欲使产物中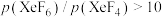 ,
,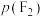 至少应保持在
至少应保持在___________ kPa。
③反应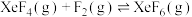 的
的
___________ 0,(填“大于”“等于”或“小于”),简述理由为___________ 。
(4)法国科学家盖•吕萨克也曾试图制备氢氟酸。1809年,他把氟化钙与硼酸混和加热,却意外地制成了一种所谓的“氟酸气”( )。已知:
)。已知: ,其中
,其中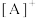 为含多个卤素原子的阳离子,
为含多个卤素原子的阳离子, 为一个正四面体结构的阴离子,则
为一个正四面体结构的阴离子,则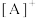 的VSEPR模型名称为
的VSEPR模型名称为___________ 。
(5)已知: ,若向1 L 0.1 mol/L的
,若向1 L 0.1 mol/L的 溶液中加入NaF固体,充分反应后,测得溶液中
溶液中加入NaF固体,充分反应后,测得溶液中 浓度为
浓度为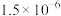 mol/L,则加入的NaF固体的质量为
mol/L,则加入的NaF固体的质量为___________ g。(忽略加入固体后溶液体积的变化,计算结果保留 2 位小数 )
(1)1670年,德国人斯瓦恩哈德无意中将萤石(
 )与浓硫酸1∶1混合在一起,产生了一种刺激性气体,这种气体能腐蚀玻璃。该气体腐蚀玻璃的化学反应方程式为
)与浓硫酸1∶1混合在一起,产生了一种刺激性气体,这种气体能腐蚀玻璃。该气体腐蚀玻璃的化学反应方程式为(2)单质氟的制备是化学史上一段悲壮的历史,直到1886年法国化学家莫瓦桑电解熔融的氟化氢钾(
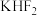 )才制得单质氟。电解过程中,两极均有气体产生,阴极的电极反应式为
)才制得单质氟。电解过程中,两极均有气体产生,阴极的电极反应式为(3)氟单质的反应性非常强,可与稀有气体氙发生反应。已知:
| 反应方程式 | 标准平衡常数 | |
| 523K | 673K | |
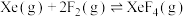 |  | 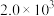 |
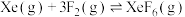 |  | 36.0 |

 ,其中
,其中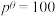 kPa,
kPa,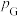 、
、 、
、 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。下图是以0.125 mol/L Xe和1.225 mol/L
 为起始量,得到的生成物在平衡体系中的分压与反应温度的关系。
为起始量,得到的生成物在平衡体系中的分压与反应温度的关系。
①制备
 的适宜温度约为
的适宜温度约为②523K时,以Xe和
 制取
制取 。反应达到平衡时,欲使产物中
。反应达到平衡时,欲使产物中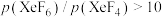 ,
,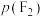 至少应保持在
至少应保持在③反应
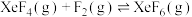 的
的
(4)法国科学家盖•吕萨克也曾试图制备氢氟酸。1809年,他把氟化钙与硼酸混和加热,却意外地制成了一种所谓的“氟酸气”(
 )。已知:
)。已知: ,其中
,其中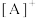 为含多个卤素原子的阳离子,
为含多个卤素原子的阳离子, 为一个正四面体结构的阴离子,则
为一个正四面体结构的阴离子,则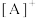 的VSEPR模型名称为
的VSEPR模型名称为(5)已知:
 ,若向1 L 0.1 mol/L的
,若向1 L 0.1 mol/L的 溶液中加入NaF固体,充分反应后,测得溶液中
溶液中加入NaF固体,充分反应后,测得溶液中 浓度为
浓度为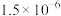 mol/L,则加入的NaF固体的质量为
mol/L,则加入的NaF固体的质量为
您最近一年使用:0次
8 . 难溶盐 可溶于盐酸,常温下,用盐酸调节
可溶于盐酸,常温下,用盐酸调节 浊液的pH,测得体系中
浊液的pH,测得体系中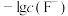 或
或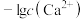 与
与 的关系如图。下列说法错误的是
的关系如图。下列说法错误的是
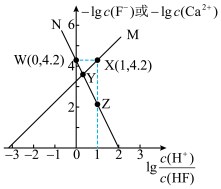
A.随着盐酸的加入,溶液中 和 和 均逐渐增大 均逐渐增大 |
B.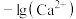 与 与 的关系对应图中曲线M 的关系对应图中曲线M |
C.常温下,难溶盐 的 的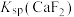 数量级为 数量级为 |
D.Y点的溶液中存在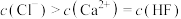 |
您最近一年使用:0次
9 . 由下列实验操作及现象能得出相应结论的是
选项 | 实验操作 | 现象 | 结论 |
A | 向 | 溶液分层,下层呈紫红色 | 氧化性: |
B | 用玻璃棒蘸取待测溶液置于火焰上灼烧 | 火焰呈黄色 | 溶液中含Na元素 |
C | 用pH计测定下列溶液的pH:① | pH:①>② |
|
D | 向浓度均为 | 出现黄色沉淀 |
|
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
10 . 五氧化二钒( )为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为
)为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为 ,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备
,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备 的一种流程如图所示:
的一种流程如图所示:
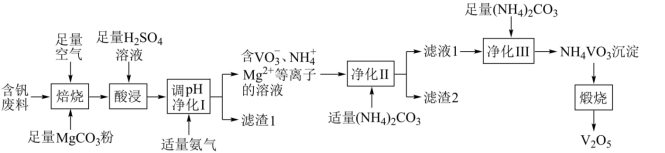
已知:①含钒离子在溶液中的存在形式与溶液pH的关系
②25℃时,难溶电解质的溶度积常数如表所示:
请回答下列问题:
(1)写出基态V原子的价层电子排布式:___________ 。
(2)“焙烧”的目的之一是将 转化成
转化成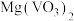 ,请写出转化的化学方程式:
,请写出转化的化学方程式:___________ 。
(3)“酸浸”时,为了提升各物质的浸出速率,除了适当升高温度外,还可以采取的措施是___________ (写一条即可)。
(4)25℃,“调pH净化Ⅰ”时需将 、
、 、
、 三种离子去除干净(浓度
三种离子去除干净(浓度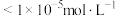 时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为
时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为___________ 。
(5)“净化Ⅱ”的目的是除 、
、 ,若该过程加入过量
,若该过程加入过量 ,可能导致的结果是
,可能导致的结果是___________ 。
(6)“滤液1”中加入 的目的是将
的目的是将 变成沉淀偏钒酸铵(
变成沉淀偏钒酸铵( ),简称“沉钒”。“沉钒”得到的
),简称“沉钒”。“沉钒”得到的 需进行洗涤、干燥,请写出证明
需进行洗涤、干燥,请写出证明 已洗净的实验操作及现象:
已洗净的实验操作及现象:___________ 。
(7)煅烧 得到的产物中,可以在该流程中循环利用的物质是
得到的产物中,可以在该流程中循环利用的物质是___________ 。
(8)为测定该产品的纯度,某同学准确称取 产品1.000g,加入过量稀硫酸使其完全转化成
产品1.000g,加入过量稀硫酸使其完全转化成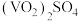 ,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的
,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的 标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中
标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中 被氧化为
被氧化为 ,该产品的纯度为
,该产品的纯度为___________ 。(计算结果保留两位小数)
 )为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为
)为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为 ,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备
,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备 的一种流程如图所示:
的一种流程如图所示:
已知:①含钒离子在溶液中的存在形式与溶液pH的关系
| 溶液pH | <4.0 | 6.0≤pH≤8.0 | >8.0 |
| 钒元素存在形式 |  |  | 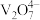 |
| 难溶电解质 |  |  |  |  |  |  |
 | 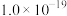 | 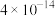 |  |  | 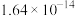 |  |
(1)写出基态V原子的价层电子排布式:
(2)“焙烧”的目的之一是将
 转化成
转化成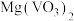 ,请写出转化的化学方程式:
,请写出转化的化学方程式:(3)“酸浸”时,为了提升各物质的浸出速率,除了适当升高温度外,还可以采取的措施是
(4)25℃,“调pH净化Ⅰ”时需将
 、
、 、
、 三种离子去除干净(浓度
三种离子去除干净(浓度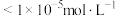 时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为
时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为(5)“净化Ⅱ”的目的是除
 、
、 ,若该过程加入过量
,若该过程加入过量 ,可能导致的结果是
,可能导致的结果是(6)“滤液1”中加入
 的目的是将
的目的是将 变成沉淀偏钒酸铵(
变成沉淀偏钒酸铵( ),简称“沉钒”。“沉钒”得到的
),简称“沉钒”。“沉钒”得到的 需进行洗涤、干燥,请写出证明
需进行洗涤、干燥,请写出证明 已洗净的实验操作及现象:
已洗净的实验操作及现象:(7)煅烧
 得到的产物中,可以在该流程中循环利用的物质是
得到的产物中,可以在该流程中循环利用的物质是(8)为测定该产品的纯度,某同学准确称取
 产品1.000g,加入过量稀硫酸使其完全转化成
产品1.000g,加入过量稀硫酸使其完全转化成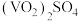 ,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的
,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的 标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中
标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中 被氧化为
被氧化为 ,该产品的纯度为
,该产品的纯度为
您最近一年使用:0次

 、KI混合溶液中依次加入少量氯水和
、KI混合溶液中依次加入少量氯水和
 溶液;②
溶液;② 溶液
溶液 酸性弱于
酸性弱于
 的
的 和KI混合溶液中滴加少量
和KI混合溶液中滴加少量 溶液
溶液


