名校
解题方法
1 . 金属镍广泛应用于制造记忆合金、储氢合金以及用作加氢反应的催化剂,是重要的战略物资,但资源匮乏。某废镍催化剂主要含有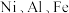 的氧化物及少量不溶性杂质,采用如下工艺流程回收其中的镍制备硫酸镍晶体
的氧化物及少量不溶性杂质,采用如下工艺流程回收其中的镍制备硫酸镍晶体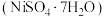 :
:

已知:① 等溶于
等溶于 溶液生成的酸根离子为
溶液生成的酸根离子为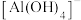 ,不是
,不是 ;
;
②溶液中金属离子开始沉淀和完全沉淀的 如下表所示:
如下表所示:
(1) 的原子序数为
的原子序数为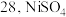 中
中 的简化电子排布式为
的简化电子排布式为_____ 。
(2)“碱浸”时发生反应的离子方程式为_____ 。
(3)滤渣③的主要成分为_____ 。
(4)利用已知②的表格数据,计算 的
的
_____ 。如果“转化”后的溶液中 浓度为
浓度为 ,则“调
,则“调 ”应控制的
”应控制的 范围是
范围是_____ 。
(5)硫酸镍在强碱性溶液中用 氧化,可沉淀出能用作镍镉电池正极材料的
氧化,可沉淀出能用作镍镉电池正极材料的 。以
。以 溶液为介质的镍镉电池正极反应式可能为
溶液为介质的镍镉电池正极反应式可能为_____ 。
(6)将分离出硫酸镍晶体后的母液收集、并入滤液③进行循环使用,这么做的意义为_____ 。
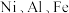 的氧化物及少量不溶性杂质,采用如下工艺流程回收其中的镍制备硫酸镍晶体
的氧化物及少量不溶性杂质,采用如下工艺流程回收其中的镍制备硫酸镍晶体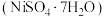 :
:
已知:①
 等溶于
等溶于 溶液生成的酸根离子为
溶液生成的酸根离子为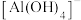 ,不是
,不是 ;
;②溶液中金属离子开始沉淀和完全沉淀的
 如下表所示:
如下表所示:| 金属离子 |  |  |  |  |
开始沉淀时 的 的 | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时 的 的 | 8.7 | 4.7 | 3.2 | 9.0 |
(1)
 的原子序数为
的原子序数为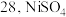 中
中 的简化电子排布式为
的简化电子排布式为(2)“碱浸”时发生反应的离子方程式为
(3)滤渣③的主要成分为
(4)利用已知②的表格数据,计算
 的
的
 浓度为
浓度为 ,则“调
,则“调 ”应控制的
”应控制的 范围是
范围是(5)硫酸镍在强碱性溶液中用
 氧化,可沉淀出能用作镍镉电池正极材料的
氧化,可沉淀出能用作镍镉电池正极材料的 。以
。以 溶液为介质的镍镉电池正极反应式可能为
溶液为介质的镍镉电池正极反应式可能为(6)将分离出硫酸镍晶体后的母液收集、并入滤液③进行循环使用,这么做的意义为
您最近一年使用:0次
名校
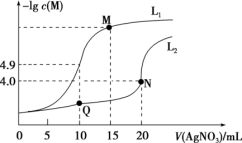
2 . 某温度下,分别向 的
的 和
和 溶液中滴加
溶液中滴加 溶液,滴加过程中
溶液,滴加过程中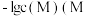 为
为 或
或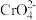 与
与 溶液体积
溶液体积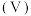 的变化关系如图所示(忽略溶液体积变化)。下列说法
的变化关系如图所示(忽略溶液体积变化)。下列说法不正确 的是
 的
的 和
和 溶液中滴加
溶液中滴加 溶液,滴加过程中
溶液,滴加过程中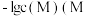 为
为 或
或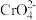 与
与 溶液体积
溶液体积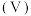 的变化关系如图所示(忽略溶液体积变化)。下列说法
的变化关系如图所示(忽略溶液体积变化)。下列说法
A.曲线 表示 表示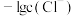 与 与 的变化关系 的变化关系 |
B. 点溶液中: 点溶液中: |
C.该温度下, 的数量级为 的数量级为 |
D.相同实验条件,若改为 的 的 和 和 溶液,曲线 溶液,曲线 中 中 点移到 点移到 点 点 |
您最近一年使用:0次
名校
解题方法
3 . 下列方案设计或现象和结论均完全正确的是
| 实验目的 | 方案设计 | 现象和结论 | |
| A | 比较CH3COONa与NaClO酸性 | 室温下,用pH试纸分别测定室温下,用pH试纸分别测定 | NaClO溶液pH较大,则酸性:CH3COOH>HClO |
| B | 探究侯氏制碱法 | 向饱和食盐水中先通入二氧化碳至饱和后,再通入过量氨气 | 溶液变浑浊,析出NaHCO3 |
| C | 比较AgCl、AgI的Ksp大小 | 向5mL0.1mol/LAgNO3溶液中先加入4滴0.1mol/LNaCl溶液,再加入4滴0.1mol/LKI溶液 | 若先产生白色沉淀,后变为黄色沉淀,则AgI的Ksp较小 |
| D | 探究Na2SO3是否变质 | 取少量待测样品溶于蒸馏水,加入足量稀盐酸,再加入BaCl2溶液 | 若有白色沉淀产生,则样品已经变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 根据下列实验操作和实验现象,得出相应实验结论错误的是
| 实验操作 | 实验现象 | 实验结论 | |
| A | 向AgCl悬浊液中加入少量KI固体 | 沉淀由白色转化为黄色 |  |
| B | 向2mL0.1mol·L-1的FeCl3溶液中加入足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性: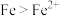 |
| C | 测定不同浓度NaHCO3溶液与Na2CO3溶液的pH | 后者pH更大 |  的水解程度小于 的水解程度小于 |
| D | 向滴有酚酞的Na2SO3溶液中加入少量BaCl2固体 | 生成白色沉淀,且红色逐渐变浅 | Na2SO3溶液中存在水解平衡 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
5 . 硫化汞(HgS)是一种难溶于水的红色颜料,其在水中的沉淀溶解平衡曲线如图所示(已知: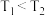 ),下列关于沉淀溶解平衡的说法错误的是
),下列关于沉淀溶解平衡的说法错误的是

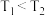 ),下列关于沉淀溶解平衡的说法错误的是
),下列关于沉淀溶解平衡的说法错误的是
A.图中a点对应的是 温度下HgS的不饱和溶液 温度下HgS的不饱和溶液 |
B.图中p、q点对应的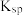 的关系为 的关系为 |
C.向m点对应的溶液中加入少量 固体,HgS的Ksp减小 固体,HgS的Ksp减小 |
| D.升高温度,溶度积增大,可实现由p点向q点的移动 |
您最近一年使用:0次
6 . 三氯化六氨合钴(Ⅲ){[Co(NH3)6]Cl3}是合成其他含钴配合物的重要原料。工业上以水钻矿(主要成分为 Co2O3,还含有少量的 Fe2O3、Al2O3、MgO、CaO、SiO2)为原料制备三氯化六氨合钴晶体。

已知:①Co2O3具有很强的氧化性,其还原产物为Co(Ⅱ);碱性条件下,Co(Ⅱ)能被 O2氧化; 易溶于热水,难溶于冷水。
②25℃时相关物质的 Ksp如下表(当溶液中某离子浓度小于10-5mol/L 时,认为该离子沉淀完全):
下列说法错误的是

已知:①Co2O3具有很强的氧化性,其还原产物为Co(Ⅱ);碱性条件下,Co(Ⅱ)能被 O2氧化; 易溶于热水,难溶于冷水。
②25℃时相关物质的 Ksp如下表(当溶液中某离子浓度小于10-5mol/L 时,认为该离子沉淀完全):
| 物质 | Co(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 | Ca(OH)2 | MgF2 | CaF2 |
| Ksp | 1×10⁻13.8 | 1×10-16.3 | 1×10-38.6 | 1×10⁻32.3 | 1×10⁻11.2 | 1×10-7.8 | 1×10-10 | 5×10-11 |
A.“浸取”时主要反应的离子方程式为   |
| B.“氧化”时,是将Fe2+ 氧化为Fe3+,滤渣Ⅱ的成分是Fe(OH)3 |
| C.“除杂”时,CoF2可将Ca2+、Mg2+转化为沉淀过滤除去,若所得滤液中Mg2+刚好沉淀完全,则此时滤液中 c(Ca2+)=5×10-6mol/L |
D.“转化”时反应的离子方程式为  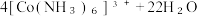 |
您最近一年使用:0次
名校
7 . 根据下列实验操作和现象所得到的实验结论正确的是
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向 溶液中加入 溶液中加入 溶液,有白色沉淀生成 溶液,有白色沉淀生成 |  与 与 发生了双水解反应 发生了双水解反应 |
| B | 向NaOH固体中加入少量稀盐酸,测得温度高于室温 | 盐酸与NaOH反应为放热反应 |
| C | 室温下,测得相同浓度的NaX和NaY溶液的pH分别为8和9 | 酸性: |
| D | 向等浓度的NaCl、KI的混合溶液中滴加少量 溶液,得到黄色沉淀 溶液,得到黄色沉淀 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-17更新
|
128次组卷
|
3卷引用:湖南省长沙麓山国际实验学校2023-2024学年高二下学期第一次学情检测化学试卷
名校
8 . 下列应用或现象主要体现的是沉淀溶解平衡原理的有
①热纯碱溶液洗涤油污的能力
②误将钡盐[ 、
、 ]当作食盐食用后,用0.5%的
]当作食盐食用后,用0.5%的 溶液解毒
溶液解毒
③溶洞的形成
④碳酸钡不能作“钡餐”而硫酸钡能
⑤泡沫灭火器灭火
①热纯碱溶液洗涤油污的能力
②误将钡盐[
 、
、 ]当作食盐食用后,用0.5%的
]当作食盐食用后,用0.5%的 溶液解毒
溶液解毒③溶洞的形成
④碳酸钡不能作“钡餐”而硫酸钡能
⑤泡沫灭火器灭火
| A.仅②③④ | B.仅①②③ | C.仅③④⑤ | D.全部 |
您最近一年使用:0次
2024-02-14更新
|
43次组卷
|
2卷引用:湖南省 邵阳市第二中学2023-2024学年高二上学期1月期末化学试题
9 . 湿法炼锌工业废水中主要阳离子有 。废水除铊的工艺流程如下。
。废水除铊的工艺流程如下。
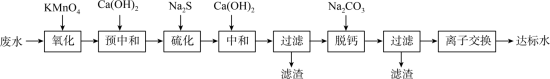
已知:① 能够在pH为0~14的范围内以离子态稳定存在,不易与OH-形成沉淀
能够在pH为0~14的范围内以离子态稳定存在,不易与OH-形成沉淀
② 易与废水中的有机物分子形成稳定的配合物,为了简便,通常用
易与废水中的有机物分子形成稳定的配合物,为了简便,通常用 表示
表示
③部分物质的
④排放标准:Tl的含量低于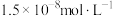
(1)已知“氧化”步骤中 被还原为
被还原为 且
且 氧化不彻底,请写出该反应的离子方程式:
氧化不彻底,请写出该反应的离子方程式:_______ 。
(2)“预中和”步骤,加 至溶液的
至溶液的 约为7,可减少“硫化”步骤中
约为7,可减少“硫化”步骤中 的使用量,还能减少
的使用量,还能减少_______ (填化学式)污染物的生成。
(3)“硫化”步骤的主要目的是除去_______ (填离子符号)。
(4)根据 计算,若使溶液中
计算,若使溶液中 的含量低于排放标准,溶液的
的含量低于排放标准,溶液的 应大于
应大于_______ ,但是实际工艺流程需在“中和”步骤加 至溶液的
至溶液的 约为9,此时仍只有
约为9,此时仍只有 左右的铊离子能得到去除,其可能原因是
左右的铊离子能得到去除,其可能原因是_______ 。
(5)“离子交换”步骤中可用普鲁士蓝{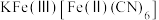 }(其摩尔质量为
}(其摩尔质量为 )中的
)中的 与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的
与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的 如下[
如下[ 未标出,占据四个互不相邻的小立方体(晶胞的
未标出,占据四个互不相邻的小立方体(晶胞的 部分)的体心]。
部分)的体心]。
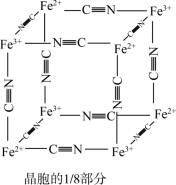
①普鲁士蓝晶胞中,Fe2+的配位数为_______ 。
②若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为_______  (设
(设 为阿伏伽德罗常数的值)。
为阿伏伽德罗常数的值)。
 。废水除铊的工艺流程如下。
。废水除铊的工艺流程如下。
已知:①
 能够在pH为0~14的范围内以离子态稳定存在,不易与OH-形成沉淀
能够在pH为0~14的范围内以离子态稳定存在,不易与OH-形成沉淀②
 易与废水中的有机物分子形成稳定的配合物,为了简便,通常用
易与废水中的有机物分子形成稳定的配合物,为了简便,通常用 表示
表示③部分物质的

| 物质 |  |  |  |  |
 | 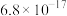 |  |  |  |
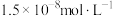
(1)已知“氧化”步骤中
 被还原为
被还原为 且
且 氧化不彻底,请写出该反应的离子方程式:
氧化不彻底,请写出该反应的离子方程式:(2)“预中和”步骤,加
 至溶液的
至溶液的 约为7,可减少“硫化”步骤中
约为7,可减少“硫化”步骤中 的使用量,还能减少
的使用量,还能减少(3)“硫化”步骤的主要目的是除去
(4)根据
 计算,若使溶液中
计算,若使溶液中 的含量低于排放标准,溶液的
的含量低于排放标准,溶液的 应大于
应大于 至溶液的
至溶液的 约为9,此时仍只有
约为9,此时仍只有 左右的铊离子能得到去除,其可能原因是
左右的铊离子能得到去除,其可能原因是(5)“离子交换”步骤中可用普鲁士蓝{
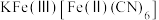 }(其摩尔质量为
}(其摩尔质量为 )中的
)中的 与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的
与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的 如下[
如下[ 未标出,占据四个互不相邻的小立方体(晶胞的
未标出,占据四个互不相邻的小立方体(晶胞的 部分)的体心]。
部分)的体心]。
①普鲁士蓝晶胞中,Fe2+的配位数为
②若该晶体的密度为
 ,则
,则 和
和 的最短距离为
的最短距离为 (设
(设 为阿伏伽德罗常数的值)。
为阿伏伽德罗常数的值)。
您最近一年使用:0次
10 . 绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是


A.图中 和 和 可分别表示 可分别表示 温度下 温度下 饱和溶液中 饱和溶液中 与 与 的浓度 的浓度 |
B.图中各点对应的 的关系为 的关系为 |
C.向 点的溶液中加入少量 点的溶液中加入少量 固体,溶液组成由 固体,溶液组成由 沿 沿 线向 线向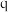 方向移动 方向移动 |
D.温度降低时,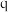 点的饱和溶液的组成由 点的饱和溶液的组成由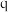 沿 沿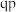 线向 线向 方向移动 方向移动 |
您最近一年使用:0次



