名校
解题方法
1 . 某锂离子电池正极由钴酸锂(LiCoO2)、铝箔、石墨等组成。某研究小组利用该锂离子电池正极材料回收制备Co3O4,同时回收锂,流程如下:

某些物质的溶解度(s)如下表所示:
请回答下列问题:
(1)写出钴元素基态原子的价层电子排布式___________ ,Co在周期表中的位置为___________ ,Co3+中有多少种运动状态的电子___________ 。
(2)过程Ⅰ浸出液产生气泡,钴酸锂发生反应的化学方程式为___________ 。
(3)过程Ⅱ中,不同pH下金属离子的去除效果如图所示。该过程加碱调节pH的范围是___________ 。

(4)过程Ⅳ中操作方法为:向滤液中加入稍过量的___________ ,充分搅拌,加热浓缩,___________ ,用热水洗涤后干燥。
(5)过程Ⅴ中,常温下CoC2O4开始转化为Co(OH)2的pH为___________ 。(已知:Ksp[Co(OH)2]=2.0×10-15,Ksp[CoC2O4]=4.0×10-8)

某些物质的溶解度(s)如下表所示:
| t/℃ | 20 | 40 | 60 | 80 |
| s(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| s(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)写出钴元素基态原子的价层电子排布式
(2)过程Ⅰ浸出液产生气泡,钴酸锂发生反应的化学方程式为
(3)过程Ⅱ中,不同pH下金属离子的去除效果如图所示。该过程加碱调节pH的范围是

(4)过程Ⅳ中操作方法为:向滤液中加入稍过量的
(5)过程Ⅴ中,常温下CoC2O4开始转化为Co(OH)2的pH为
您最近一年使用:0次
2 . 常温下,分别向体积均为10mL、浓度均为0.1mol/L的FeCl2和MnCl2溶液中滴加0.1mol/L的K2S溶液,滴加过程中溶液-1gc(Fe2+)和-1gc(Mn2+)与滴入K2S溶液体积(V)的关系如图所示。[已知:Ksp(MnS)>Ksp(FeS),lg3≈0.5,忽略溶液混合时温度和体积的变化],下列说法正确的是
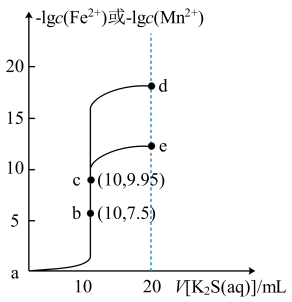

| A.a-b-e为MnCl2溶液的滴定曲线 |
| B.加入过量难溶的FeS可除去FeCl2溶液中混有的Mn2+ |
| C.e点纵坐标约为12.5 |
| D.溶液的pH:c>d>a |
您最近一年使用:0次
2024-01-13更新
|
105次组卷
|
2卷引用:湖南省长沙市麓山国际实验学校2023-2024学年高二上学期第三次月考化学试题
解题方法
3 . 二氧化锰是工业上常用的氧化剂、催化剂,以菱锰矿(主要成分 ,还含有
,还含有 、
、 、
、 、
、 、
、 、
、 等杂质)为原料制备
等杂质)为原料制备 的工艺流程如图:
的工艺流程如图:

已知: 、
、 、
、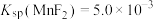
回答下列问题:
(1)酸浸时为了提高浸出效率,除升温外,还可以采取的措施是__________ (任写一种)。
(2)“中和除杂1”是将铁、铝元素转化为沉淀除去,物质X最好选用__________(填标号)。
(3)“除杂2”除去的主要离子是__________ (填离子符号)。
(4)用惰性电极电解 溶液获得
溶液获得 的过程如图所示。
的过程如图所示。

①A为电源__________ 极。
②理论上,当电路中转移10mol电子时,左室产生气体的质量为__________ g。
③右室的电极反应式为__________ 。
(5)电解后的废液中依然存在 ,通常用
,通常用 处理。25℃,向含有
处理。25℃,向含有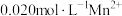 的溶液中通入一定量的
的溶液中通入一定量的 气体,当
气体,当 时,
时, 开始沉淀,此时溶液的pH=
开始沉淀,此时溶液的pH=__________ 。[已知:25℃, 的电离常数
的电离常数 ,
,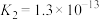 ;
; ]。
]。
 ,还含有
,还含有 、
、 、
、 、
、 、
、 、
、 等杂质)为原料制备
等杂质)为原料制备 的工艺流程如图:
的工艺流程如图:
已知:
 、
、 、
、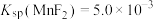
回答下列问题:
(1)酸浸时为了提高浸出效率,除升温外,还可以采取的措施是
(2)“中和除杂1”是将铁、铝元素转化为沉淀除去,物质X最好选用__________(填标号)。
A. | B. | C.NaOH | D. |
(3)“除杂2”除去的主要离子是
(4)用惰性电极电解
 溶液获得
溶液获得 的过程如图所示。
的过程如图所示。
①A为电源
②理论上,当电路中转移10mol电子时,左室产生气体的质量为
③右室的电极反应式为
(5)电解后的废液中依然存在
 ,通常用
,通常用 处理。25℃,向含有
处理。25℃,向含有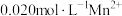 的溶液中通入一定量的
的溶液中通入一定量的 气体,当
气体,当 时,
时, 开始沉淀,此时溶液的pH=
开始沉淀,此时溶液的pH= 的电离常数
的电离常数 ,
,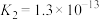 ;
; ]。
]。
您最近一年使用:0次
2024-01-13更新
|
143次组卷
|
2卷引用:湖南省益阳博雅高级中学2023-2024学年高二上学期期末考试化学试题
9-10高三·湖北黄冈·阶段练习
名校
解题方法
4 . 已知:①相同温度下的溶解度为 ,
,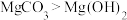 ;②溶解并电离出
;②溶解并电离出 的能力为
的能力为 。则下列离子方程式错误的是
。则下列离子方程式错误的是
 ,
,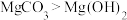 ;②溶解并电离出
;②溶解并电离出 的能力为
的能力为 。则下列离子方程式错误的是
。则下列离子方程式错误的是A. |
B.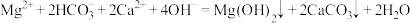 |
C. |
D.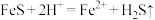 |
您最近一年使用:0次
2024-01-11更新
|
48次组卷
|
26卷引用:2017届湖南省益阳市箴言中学高三上学期第二次月考化学试卷
2017届湖南省益阳市箴言中学高三上学期第二次月考化学试卷(已下线)湖北省黄冈中学2011届高三年级十月月考化学试题(已下线)2012年人教版高中化学选修4 3.4难溶电解质的溶解平衡练习卷(已下线)2013届辽宁省五校协作体高三冲刺最后一模化学试卷(已下线)2013届北京市通州区高三年级上学期期末摸底考试理综化学试卷(已下线)2014年高考化学一轮复习课后规范训练8-4练习卷(已下线)2013-2014福建省南安一中高二下学期期末考试化学试卷2016届上海市十三校高三上学期第一次联考化学试卷2015-2016学年四川省彭州中学高二下2月月考化学试卷2016-2017学年湖北省襄阳五中高二上10月月考化学试卷天津市耀华中学2018届高三上学期第一次月考化学试题云南省会泽县茚旺高级中学2018-2019学年高二上学期12月月考化学试题上海市南汇中学2019届高三下学期3月等级月考卷化学试题(已下线)第8章 单元测试(测)-《2020年高考一轮复习讲练测》云南省玉溪市江川区二中2019-2020学年高二上学期期末考试化学试题云南省普洱市江城县第一中学2019—2020学年高二上学期期末考试化学试题四川省遂宁市船山区第二中学校2019-2020学年高二下学期期中考试化学试题四川省成都市实验外国语学校(西区)2020-2021学年高二上学期12月月考化学测试卷四川省邻水实验学校2020-2021学年高二上学期第三阶段考试化学试题(已下线)考向27 难溶电解质的溶解平衡-备战2022年高考化学一轮复习考点微专题(已下线)专题3 溶液中的离子反应 综合评价(2)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)作业(二十一) 沉淀溶解平衡的应用作业(二十二) 沉淀的溶解与生成、转化及应用云南省曲靖市第一中学2023-2024学年高二上学期11月期中考试化学试题河南省部分高中2023-2024学年高二上学期1月联考化学试题 山西省阳泉市城区瑞源教育培训学校2023-2024学年高二上学期12月大联考化学试题
名校
解题方法
5 . 绿矾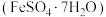 主要用于净水、照相制版及治疗缺铁性贫血等。工业上利用生活废铁(主要成分为
主要用于净水、照相制版及治疗缺铁性贫血等。工业上利用生活废铁(主要成分为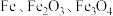 ,以及少量
,以及少量 等)制备绿矾的一种工艺流程如下:
等)制备绿矾的一种工艺流程如下:

回答下列问题:
(1)“焙烧”的目的是___________ ;“碱煮水洗”可除去的物质为___________ 。
(2)提高“酸溶”反应速率的措施是___________ (任写一条)。“反应”时发生反应的离子方程式为___________ 。
(3)隔绝空气的目的是___________ ;一系列操作包括___________ 、干燥。
(4)“酸溶”后,若溶液中 为
为 ,为了减少损失,常温下必须控制溶液的
,为了减少损失,常温下必须控制溶液的 小于
小于___________  已知:
已知: 。
。
(5)纯度测定:取 绿矾,配成
绿矾,配成 溶液,取
溶液,取 溶液于锥形瓶中,用
溶液于锥形瓶中,用 酸性
酸性 溶液滴定,三次滴定消耗标准液的平均值为
溶液滴定,三次滴定消耗标准液的平均值为 。取硫酸亚铁溶液的仪器名称为
。取硫酸亚铁溶液的仪器名称为___________ ;绿矾的纯度为___________  (用含a的代数式表示)。
(用含a的代数式表示)。
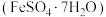 主要用于净水、照相制版及治疗缺铁性贫血等。工业上利用生活废铁(主要成分为
主要用于净水、照相制版及治疗缺铁性贫血等。工业上利用生活废铁(主要成分为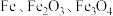 ,以及少量
,以及少量 等)制备绿矾的一种工艺流程如下:
等)制备绿矾的一种工艺流程如下:
回答下列问题:
(1)“焙烧”的目的是
(2)提高“酸溶”反应速率的措施是
(3)隔绝空气的目的是
(4)“酸溶”后,若溶液中
 为
为 ,为了减少损失,常温下必须控制溶液的
,为了减少损失,常温下必须控制溶液的 小于
小于 已知:
已知: 。
。(5)纯度测定:取
 绿矾,配成
绿矾,配成 溶液,取
溶液,取 溶液于锥形瓶中,用
溶液于锥形瓶中,用 酸性
酸性 溶液滴定,三次滴定消耗标准液的平均值为
溶液滴定,三次滴定消耗标准液的平均值为 。取硫酸亚铁溶液的仪器名称为
。取硫酸亚铁溶液的仪器名称为 (用含a的代数式表示)。
(用含a的代数式表示)。
您最近一年使用:0次
名校
解题方法
6 . 莫尔法测定生理盐水浓度的过程如下:移取 稀释后的生理盐水置于
稀释后的生理盐水置于 锥形瓶中,加入3滴
锥形瓶中,加入3滴 指示剂,用
指示剂,用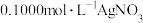 标准溶液滴定至终点。重复3次,消耗标准溶液的体积平均为
标准溶液滴定至终点。重复3次,消耗标准溶液的体积平均为 ,然后计算出
,然后计算出 的浓度。已知:
的浓度。已知: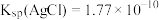 ;
;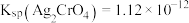 ;
; 为砖红色沉淀。下列关于本实验的说法正确的是
为砖红色沉淀。下列关于本实验的说法正确的是
 稀释后的生理盐水置于
稀释后的生理盐水置于 锥形瓶中,加入3滴
锥形瓶中,加入3滴 指示剂,用
指示剂,用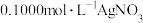 标准溶液滴定至终点。重复3次,消耗标准溶液的体积平均为
标准溶液滴定至终点。重复3次,消耗标准溶液的体积平均为 ,然后计算出
,然后计算出 的浓度。已知:
的浓度。已知: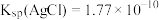 ;
;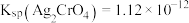 ;
; 为砖红色沉淀。下列关于本实验的说法正确的是
为砖红色沉淀。下列关于本实验的说法正确的是A.可用酸式滴定管装 标准溶液 标准溶液 |
B.该稀释后的生理盐水浓度为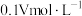 |
| C.实验中若用生理盐水润洗锥形瓶将导致测定结果偏低 |
D.在相同浓度的 和 和 混合溶液中滴入 混合溶液中滴入 溶液,先出现砖红色沉淀 溶液,先出现砖红色沉淀 |
您最近一年使用:0次
2024-01-11更新
|
163次组卷
|
2卷引用:湖南省长沙市长郡中学2024届高三上学期期末适应性考试化学试题
7 . 已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4mol/L的Na2CO3溶液与CaCl2溶液等体积混合,若要产生沉淀,则所用CaCl2溶液的浓度至少应为
| A.2.8×10-2mol/L | B.1.4×10-5mol/L | C.5.6×10-5mol/L | D.2.8×10-5mol/L |
您最近一年使用:0次
2024-01-10更新
|
112次组卷
|
38卷引用:湖南省衡阳县第四中学2018-2019学年高二第一学期实验班9月月考化学试题
湖南省衡阳县第四中学2018-2019学年高二第一学期实验班9月月考化学试题江西省抚州市临川区第一中学2017-2018学年高二上学期期中考试化学试题云南省中央民族大学附属中学芒市国际学校2017-2018学年高二上学期末考试化学试题河北省沧州市盐山中学2018-2019学年高二上学期12月月考化学试题【全国百强校】河北省石家庄市第二中学2018-2019学年高二上学期期中考试化学试题陕西省吴起高级中学2019-2020学年高二上学期期中考试化学(能力卷)试题陕西省吴起高级中学2019-2020学年高二上学期期中考试化学(基础卷)试题(已下线)2019年11月13日 《每日一题》人教版(选修4)——溶度积的有关计算河北省邯郸市大名县第一中学2019-2020学年高二上学期12月月考化学试题(清北组)2020年春季人教版高中化学选修4第三章《水溶液中的离子平衡》测试卷鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡 课时1 沉淀溶解平衡及其应用高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 课时1 溶解平衡及其应用(已下线)第3章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)第三章 水溶液中的离子平衡(基础过关)-2020-2021学年高二化学单元测试定心卷(人教版选修4)(已下线)易错17 难溶电解质的溶解平衡及应用-备战2021年高考化学一轮复习易错题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡(已下线)3.4 难溶电解质的溶解平衡(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)吉林省公主岭市范家屯镇第一中学2020-2021学年高二上学期期末两校联考化学试题甘肃省天水市一中2020-2021学年高二上学期第二学段(期末)考试化学试题吉林省白城市第一中学2020-2021学年高二下学期3月月考化学试题广西钦州市2020-2021学年高二下学期期末考试化学试题海南省北京师范大学万宁附属中学2021-2022学年高二上学期第一次月考化学试题 安徽省芜湖市第一中学2021-2022学年高二上学期第二次月末诊断测试化学试题(已下线)3.4.1 难溶电解质的沉淀溶解平衡(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)新疆昌吉州2021-2022学年高二上学期期末考试化学试题陕西省渭南市大荔县2021-2022学年高二上学期期末考试化学试题安徽省阜阳市临泉县第一中学2021-2022学年高二下学期开学考试化学试题云南省文山州麻栗坡县2021-2022学年高二上学期期中测试化学试题(已下线)3.4.1 沉淀溶解平衡-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)辽宁省重点高中沈阳市郊联体2022-2023学年高二上学期期中考试化学试题辽宁省沈阳市辽中区第二高级中学2022-2023学年高二上学期期中考试化学试题(已下线)专题突破卷09 水溶液中的离子反应与平衡 ?-2024年高考化学一轮复习考点通关卷(新教材新高考)作业(二十) 沉淀溶解平衡与溶度积第三章 第四节 沉淀溶解平衡 第1课时 沉淀溶解平衡与溶度积黑龙江省实验中学2023-2024学年高二上学期12月月考化学试题山西省朔州市怀仁县阳高一中2023-2024学年高二上学期11月化学试卷广东省湛江市雷州市第二中学2023-2024学年高二下学期开学化学试题陕西省 韩城市象山中学2023-2024学年高二上学期第三次月考化学试题
名校
解题方法
8 . 以下是实验室模拟以工业废渣锌灰(主要成分为Zn、 ,还含有
,还含有 、
、 、
、 等杂质)为原料制备半导体材料纳米
等杂质)为原料制备半导体材料纳米 的工艺流程:
的工艺流程:
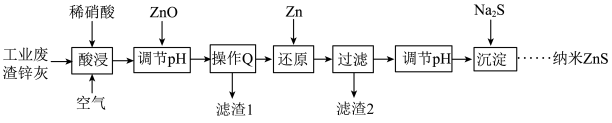
已知:ⅰ.常温下, ;
; 。
。
ⅱ.当离子浓度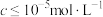 时,可认为沉淀完全。
时,可认为沉淀完全。
下列说法错误的是
 ,还含有
,还含有 、
、 、
、 等杂质)为原料制备半导体材料纳米
等杂质)为原料制备半导体材料纳米 的工艺流程:
的工艺流程:
已知:ⅰ.常温下,
 ;
; 。
。ⅱ.当离子浓度
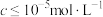 时,可认为沉淀完全。
时,可认为沉淀完全。下列说法错误的是
A.第一次调节pH应控制 |
| B.操作Q用到的玻璃仪器有烧杯、漏斗、玻璃棒 |
C.“沉淀”步骤若改用 试剂,反应的离子方程式为 试剂,反应的离子方程式为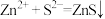 |
| D.“酸浸”步骤中通空气的目的可能是考虑到节约硝酸用量和环境保护 |
您最近一年使用:0次
名校
解题方法
9 . 三氯化钌( )是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从
)是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从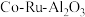 催化剂废料中分离制各
催化剂废料中分离制各 和
和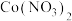 的一种工艺流程如图所示。
的一种工艺流程如图所示。
(1)基态 原子的价电子排布式为
原子的价电子排布式为___________ 。
(2)“焙烧”后所得固体主要成分为 、
、 、
、 和
和___________ 。
(3)“还原”过程会产生 和
和 沉淀,该反应的化学方程式为
沉淀,该反应的化学方程式为______________________ 。
(4)“酸溶”过程中,先加入盐酸溶解 ,然后加入盐酸羟胺(
,然后加入盐酸羟胺( )得到
)得到 和
和 。则该两种产物的物质的量之比为
。则该两种产物的物质的量之比为___________ 。
(5)“蒸发结晶”在真空度为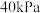 时进行(此时水的沸点是
时进行(此时水的沸点是 ),其目的是
),其目的是___________ 。
(6)若维持 不变,让
不变,让 沉淀完全(
沉淀完全( 浓度不高于
浓度不高于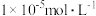 ),则混合体系中
),则混合体系中 的浓度不低于
的浓度不低于___________ 。[已知: ,
,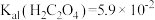 ,
, 结果保留三位小数]
结果保留三位小数]
(7)“沉钴”时,若得到的是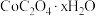 晶体,该反应的离子方程式为
晶体,该反应的离子方程式为______________________ 。
(8)该流程中,还有一种重要成分 未提取,你认为在哪一步骤后进行最合适:
未提取,你认为在哪一步骤后进行最合适:___________ 。
 )是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从
)是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从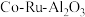 催化剂废料中分离制各
催化剂废料中分离制各 和
和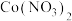 的一种工艺流程如图所示。
的一种工艺流程如图所示。
(1)基态
 原子的价电子排布式为
原子的价电子排布式为(2)“焙烧”后所得固体主要成分为
 、
、 、
、 和
和(3)“还原”过程会产生
 和
和 沉淀,该反应的化学方程式为
沉淀,该反应的化学方程式为(4)“酸溶”过程中,先加入盐酸溶解
 ,然后加入盐酸羟胺(
,然后加入盐酸羟胺( )得到
)得到 和
和 。则该两种产物的物质的量之比为
。则该两种产物的物质的量之比为(5)“蒸发结晶”在真空度为
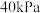 时进行(此时水的沸点是
时进行(此时水的沸点是 ),其目的是
),其目的是(6)若维持
 不变,让
不变,让 沉淀完全(
沉淀完全( 浓度不高于
浓度不高于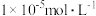 ),则混合体系中
),则混合体系中 的浓度不低于
的浓度不低于 ,
,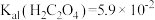 ,
, 结果保留三位小数]
结果保留三位小数](7)“沉钴”时,若得到的是
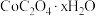 晶体,该反应的离子方程式为
晶体,该反应的离子方程式为(8)该流程中,还有一种重要成分
 未提取,你认为在哪一步骤后进行最合适:
未提取,你认为在哪一步骤后进行最合适:
您最近一年使用:0次
2024-01-09更新
|
1296次组卷
|
6卷引用:湖南省株洲市2024届高三上学期教学质量统一检测化学试题
湖南省株洲市2024届高三上学期教学质量统一检测化学试题湖南省株洲市2023-2024学年高三上学期教学质量统一检测化学试卷2024届湖南省长沙市雅礼中学高三下学期3月综合测试(一)化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)大题01 化工流程综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)2024届江西省贵溪市实验中学高三下学期5月模拟考试压轴(三)化学试卷
名校
解题方法
10 . 下列指定反应的离子方程式正确的是
A.饱和氯水中通入 至溶液颜色褪去: 至溶液颜色褪去: |
B.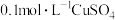 溶液中加入过量浓氨水: 溶液中加入过量浓氨水: |
C.向滴有酚酞的 溶液中滴入盐酸至红色恰好褪去: 溶液中滴入盐酸至红色恰好褪去: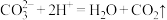 |
D. 溶液中加入足量石灰乳: 溶液中加入足量石灰乳: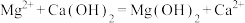 |
您最近一年使用:0次
2024-01-07更新
|
132次组卷
|
2卷引用:湖南省长沙市雅礼中学2023-2024学年高三上学期月考试卷(六)化学试题



