1 . 磷的含氧酸及其盐是一类重要的化工产品,广泛用于食品、肥料、去油去污、防腐蚀、防锈、锅炉水处理等。请回答下列问题:
(1)次磷酸(H3PO2)是一种精细化工产品。向10 mL0.02 mol • L-1H3PO2溶液中加入20 mL等物质的量浓度的NaOH溶液后,所得的溶液中只有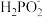 、OH-两种阴离子,则H3PO2是
、OH-两种阴离子,则H3PO2是_______ (填“一元酸”、“二元酸”或“三元酸”)。
(2)已知25℃时K(H3PO2) =1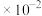 ,该H3PO2溶液的PH为
,该H3PO2溶液的PH为__________ 。
(3)亚磷酸(H3PO3)是二元中强酸,25℃时亚磷酸的电离常数K1= 5.0 × 10-2、K2=2.6 ×10-3。
①电离常数K只与温度有关,当温度升高时,K值_____ (填“增大”或“减小”)。
②试从电离平衡移动的角度解释K1、K2数据的差异:____________ 。
(4)25℃时,已知HF的电离常数= 3.6×10-4(H3PO4的电离常数K1=7.5×10-3,K2=6.2×10-8,K3=4.4×10-13。则足量NaF溶液和H3PO4溶液反应的离子方程式为________ 。
(1)次磷酸(H3PO2)是一种精细化工产品。向10 mL0.02 mol • L-1H3PO2溶液中加入20 mL等物质的量浓度的NaOH溶液后,所得的溶液中只有
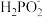 、OH-两种阴离子,则H3PO2是
、OH-两种阴离子,则H3PO2是(2)已知25℃时K(H3PO2) =1
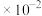 ,该H3PO2溶液的PH为
,该H3PO2溶液的PH为(3)亚磷酸(H3PO3)是二元中强酸,25℃时亚磷酸的电离常数K1= 5.0 × 10-2、K2=2.6 ×10-3。
①电离常数K只与温度有关,当温度升高时,K值
②试从电离平衡移动的角度解释K1、K2数据的差异:
(4)25℃时,已知HF的电离常数= 3.6×10-4(H3PO4的电离常数K1=7.5×10-3,K2=6.2×10-8,K3=4.4×10-13。则足量NaF溶液和H3PO4溶液反应的离子方程式为
您最近一年使用:0次
2020-10-19更新
|
508次组卷
|
3卷引用:山西省长治市上党区一中2021-2022学年高二上学期10月月考化学试题
2 . (1)已知:常温下浓度为0.1mol/L的下列溶液的pH如表
①等体积等物质的量浓度的NaCl溶液与NaClO溶液中Cl-和ClO-离子个数:Cl-_________ ClO-,浓度相等的NaClO和CH3COOK溶液中:[c(Na+)-c(ClO-)]__________ [c(K+)-c(CH3COO-)](填“>”“<”或“=”)
②HCO3-的水解常数为__________ (填写具体数值),在相同温度下,同浓度的CH3COOH、H2CO3、HClO三种酸溶液的导电能力大小为__________
(2)常温下,向pH=a的醋酸中加入等体积NaOH时后呈中性,则此NaOH的pH_____ 14-a(>、<、=)
(3)常温下,已知0.1mol﹒L-1一元酸HA溶液中 =1×10-6。
=1×10-6。
①常温下,0.1mol﹒L-1HA溶液的pH=_____ ;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:_____ 。
(4)常温下,amol/L氨水与等体积0.1mol/LH2SO4溶液混合后溶液显中性,则NH3·H2O的电离平衡常数Kb=_____
| 溶质 | NaCl | CH3COOK | Na2CO3 | NaClO | NaHCO3 |
| pH | 7 | 8.1 | 11.6 | 9.7 | 8.3 |
①等体积等物质的量浓度的NaCl溶液与NaClO溶液中Cl-和ClO-离子个数:Cl-
②HCO3-的水解常数为
(2)常温下,向pH=a的醋酸中加入等体积NaOH时后呈中性,则此NaOH的pH
(3)常温下,已知0.1mol﹒L-1一元酸HA溶液中
 =1×10-6。
=1×10-6。①常温下,0.1mol﹒L-1HA溶液的pH=
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:
(4)常温下,amol/L氨水与等体积0.1mol/LH2SO4溶液混合后溶液显中性,则NH3·H2O的电离平衡常数Kb=
您最近一年使用:0次
2020-04-28更新
|
103次组卷
|
2卷引用:山西大学附属中学2020-2021学年高二上学期期中考试化学试题



