名校
1 . 为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I:反应产物的定性探究
按如图装置(固定装置已略去)进行实验:___________ 。
(2)A装置中发生反应的化学方程式为___________ ,F装置的烧杯中发生反应的离子方程式是___________ ,B装置中的现象是___________ 。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是___________ 。
实验II:硫酸铜产率的测定
将铜与浓硫酸反应所得溶液配制成250.00mL溶液,取该溶液25.00mL置于锥形瓶中,向其中加入足量KI溶液和3~5滴淀粉溶液,摇匀,用0.3600mol/L的 溶液进行滴定。重复滴定3次,3次平均消耗该
溶液进行滴定。重复滴定3次,3次平均消耗该 溶液25.00mL。(已知:
溶液25.00mL。(已知: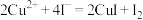 ,
, )
)
(4)达到滴定终点的现象是___________ 。
(5)若反应消耗铜的质量为6.4g,则硫酸铜的产率为___________ 。
(6)下列会导致测定结果偏大的是___________。
实验I:反应产物的定性探究
按如图装置(固定装置已略去)进行实验:

(2)A装置中发生反应的化学方程式为
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是
实验II:硫酸铜产率的测定
将铜与浓硫酸反应所得溶液配制成250.00mL溶液,取该溶液25.00mL置于锥形瓶中,向其中加入足量KI溶液和3~5滴淀粉溶液,摇匀,用0.3600mol/L的
 溶液进行滴定。重复滴定3次,3次平均消耗该
溶液进行滴定。重复滴定3次,3次平均消耗该 溶液25.00mL。(已知:
溶液25.00mL。(已知: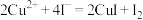 ,
, )
)(4)达到滴定终点的现象是
(5)若反应消耗铜的质量为6.4g,则硫酸铜的产率为
(6)下列会导致测定结果偏大的是___________。
A.配制 溶液定容时仰视 溶液定容时仰视 |
| B.滴定前锥形瓶未干燥 |
| C.滴定前滴定管尖嘴出现气泡,滴定终点时气泡消失 |
| D.滴定终点时,滴定管尖嘴悬挂一滴液滴 |
您最近一年使用:0次
2023-09-24更新
|
48次组卷
|
2卷引用:广西防城港市实验高级中学2023-2024学年高二下学期期中考试化学试题
2 . 若用AG表示溶液的酸度,其表达式为:AG=lg[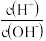 ]。室温下,实验室里用0.10mol/L的盐酸溶液滴定10 mL0.10mol/LMOH溶液,滴定曲线如图所示,下列说法正确的是
]。室温下,实验室里用0.10mol/L的盐酸溶液滴定10 mL0.10mol/LMOH溶液,滴定曲线如图所示,下列说法正确的是
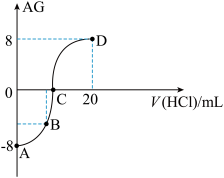
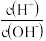 ]。室温下,实验室里用0.10mol/L的盐酸溶液滴定10 mL0.10mol/LMOH溶液,滴定曲线如图所示,下列说法正确的是
]。室温下,实验室里用0.10mol/L的盐酸溶液滴定10 mL0.10mol/LMOH溶液,滴定曲线如图所示,下列说法正确的是
| A.MOH电离方程式是MOH=M++OH- |
| B.C 点加入盐酸的体积为10mL |
| C.若B点加入的盐酸溶液体积为5 mL,所得溶液中:c(M+)+2c(H+)=c(MOH) + 2c(OH-) |
| D.滴定过程中从A点到D点溶液中水的电离程度逐渐增大 |
您最近一年使用:0次



