名校
解题方法
1 . 以某菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料通过以下方法可获得碳酸锰粗产品。
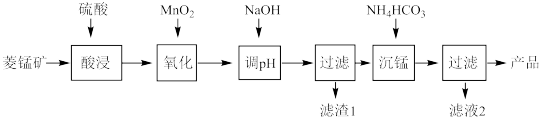
(已知:Ksp(MnCO3) = 2.2×10−11,Ksp[Mn(OH)2] = 1.9×10−13,Ksp[Al(OH)3] = 1.3×10−33)
(1)滤渣1中,含铁元素的物质主要是_______ (填化学式,下同);加NaOH调节溶液的pH约为5,如果pH过大,可能导致滤渣1中_______ 含量减少。
(2)滤液2中,+1价阳离子除了H+外还有_________ (填离子符号)。
(3)取“沉锰”前溶液amL于锥形瓶中,加入少量AgNO3溶液(作催化剂)和过量的1.5%(NH4)2S2O8溶液,加热,Mn2+被氧化为MnO4−,反应一段时间后再煮沸5min[除去过量的(NH4)2S2O8],冷却至室温。选用适宜的指示剂,用b mol·L−1的(NH4)2Fe(SO4)标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2标准溶液V mL。
① Mn2+与(NH4)2S2O8反应的还原产物为____________ (填化学式)。
② “沉锰”前溶液中c(Mn2+) =___________ mol·L−1(列出表达式)。
(4)其他条件不变,“沉锰”过程中锰元素回收率与NH4HCO3初始浓度(c0)、反应时间的关系如下图所示。
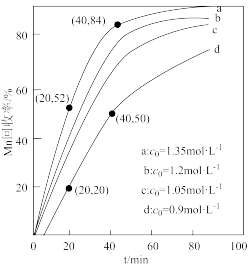
①NH4HCO3初始浓度越大,锰元素回收率越___ (填“高”或“低”),简述原因_______ 。
② 若溶液中c(Mn2+) =1.0 mol·L−1,加入等体积1.8 mol·L−1 NH4HCO3溶液进行反应,计算20~40 min内v(Mn2+) =_________ mol·L−1·min−1。

(已知:Ksp(MnCO3) = 2.2×10−11,Ksp[Mn(OH)2] = 1.9×10−13,Ksp[Al(OH)3] = 1.3×10−33)
(1)滤渣1中,含铁元素的物质主要是
(2)滤液2中,+1价阳离子除了H+外还有
(3)取“沉锰”前溶液amL于锥形瓶中,加入少量AgNO3溶液(作催化剂)和过量的1.5%(NH4)2S2O8溶液,加热,Mn2+被氧化为MnO4−,反应一段时间后再煮沸5min[除去过量的(NH4)2S2O8],冷却至室温。选用适宜的指示剂,用b mol·L−1的(NH4)2Fe(SO4)标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2标准溶液V mL。
① Mn2+与(NH4)2S2O8反应的还原产物为
② “沉锰”前溶液中c(Mn2+) =
(4)其他条件不变,“沉锰”过程中锰元素回收率与NH4HCO3初始浓度(c0)、反应时间的关系如下图所示。

①NH4HCO3初始浓度越大,锰元素回收率越
② 若溶液中c(Mn2+) =1.0 mol·L−1,加入等体积1.8 mol·L−1 NH4HCO3溶液进行反应,计算20~40 min内v(Mn2+) =
您最近一年使用:0次
2016-12-09更新
|
753次组卷
|
3卷引用:陕西省咸阳市实验中学 2022-2023学年高二上学期第三次月考化学试题



