解题方法
1 . 电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种滴定分析方法。在一定条件下,用 的高氯酸溶液滴定
的高氯酸溶液滴定 某弱酸酸式盐
某弱酸酸式盐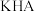 溶液,测得电压变化与滴入
溶液,测得电压变化与滴入 溶液的体积关系如图所示。做空白对照实验,消耗
溶液的体积关系如图所示。做空白对照实验,消耗 溶液的体积为
溶液的体积为 。已知N为滴定终点。下列说法正确的是
。已知N为滴定终点。下列说法正确的是

 的高氯酸溶液滴定
的高氯酸溶液滴定 某弱酸酸式盐
某弱酸酸式盐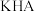 溶液,测得电压变化与滴入
溶液,测得电压变化与滴入 溶液的体积关系如图所示。做空白对照实验,消耗
溶液的体积关系如图所示。做空白对照实验,消耗 溶液的体积为
溶液的体积为 。已知N为滴定终点。下列说法正确的是
。已知N为滴定终点。下列说法正确的是
A.初始时该酸式盐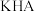 的浓度为 的浓度为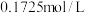 |
B.水的电离程度: |
C.已知 的 的 ,若M点处为中性,则有 ,若M点处为中性,则有 约为0 约为0 |
D.若M点时溶液呈中性,则存在: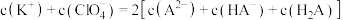 |
您最近一年使用:0次
2 . 在含单质碘的KI溶液中存在可逆反应: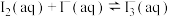 ,为测定该反应的平衡常数K进行如下实验,实验步骤如下:
,为测定该反应的平衡常数K进行如下实验,实验步骤如下:
①在装有 的KI溶液的碘量瓶中加入足量
的KI溶液的碘量瓶中加入足量 ,充分搅拌溶解,待过量的固体碘沉于瓶底后,取42.5mL上层清液,用
,充分搅拌溶解,待过量的固体碘沉于瓶底后,取42.5mL上层清液,用 萃取,充分振荡、静置、分液,得到42.5mL萃取后的水溶液、
萃取,充分振荡、静置、分液,得到42.5mL萃取后的水溶液、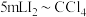 溶液。
溶液。
②取萃取后的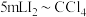 溶液于碘量瓶中,加水充分振荡,再加入质量分数为0.01%KI溶液,充分振荡后,静置5分钟,注入4mL0.2%的淀粉溶液,用
溶液于碘量瓶中,加水充分振荡,再加入质量分数为0.01%KI溶液,充分振荡后,静置5分钟,注入4mL0.2%的淀粉溶液,用 的
的 标准溶液滴定,平行滴定3次,平均消耗
标准溶液滴定,平行滴定3次,平均消耗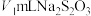 溶液。
溶液。
③将萃取后的水溶液42.5mL移入碘量瓶中,注入4mL0.2%的淀粉溶液,用 的
的 标准溶液滴定,平行滴定3次,平均消耗
标准溶液滴定,平行滴定3次,平均消耗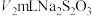 溶液。
溶液。
已知:(1)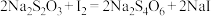 ;(2)
;(2) 与
与 难溶于
难溶于 ;(3)达到溶解平衡后,
;(3)达到溶解平衡后, 在
在 层和水层中的分配比
层和水层中的分配比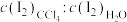 为
为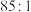
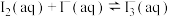 ,为测定该反应的平衡常数K进行如下实验,实验步骤如下:
,为测定该反应的平衡常数K进行如下实验,实验步骤如下:①在装有
 的KI溶液的碘量瓶中加入足量
的KI溶液的碘量瓶中加入足量 ,充分搅拌溶解,待过量的固体碘沉于瓶底后,取42.5mL上层清液,用
,充分搅拌溶解,待过量的固体碘沉于瓶底后,取42.5mL上层清液,用 萃取,充分振荡、静置、分液,得到42.5mL萃取后的水溶液、
萃取,充分振荡、静置、分液,得到42.5mL萃取后的水溶液、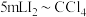 溶液。
溶液。②取萃取后的
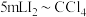 溶液于碘量瓶中,加水充分振荡,再加入质量分数为0.01%KI溶液,充分振荡后,静置5分钟,注入4mL0.2%的淀粉溶液,用
溶液于碘量瓶中,加水充分振荡,再加入质量分数为0.01%KI溶液,充分振荡后,静置5分钟,注入4mL0.2%的淀粉溶液,用 的
的 标准溶液滴定,平行滴定3次,平均消耗
标准溶液滴定,平行滴定3次,平均消耗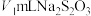 溶液。
溶液。③将萃取后的水溶液42.5mL移入碘量瓶中,注入4mL0.2%的淀粉溶液,用
 的
的 标准溶液滴定,平行滴定3次,平均消耗
标准溶液滴定,平行滴定3次,平均消耗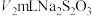 溶液。
溶液。已知:(1)
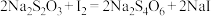 ;(2)
;(2) 与
与 难溶于
难溶于 ;(3)达到溶解平衡后,
;(3)达到溶解平衡后, 在
在 层和水层中的分配比
层和水层中的分配比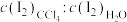 为
为

A.步骤①中萃取时若没有充分振荡,则导致所测 值偏小 值偏小 |
| B.步骤①中吸取上层清液时,不慎吸入碘固体,则测得的K偏大 |
| C.步骤②中滴定前滴定管有气泡,滴定后气泡消失,则测得的K偏大 |
| D.步骤③中滴定终点时俯视读数,则测得的K偏小 |
您最近一年使用:0次
2023-11-11更新
|
436次组卷
|
3卷引用:【定心卷】3.2.3 酸碱中和滴定随堂练习-人教版2023-2024学年选择性必修1
3 . 复盐的组成
在NH4Cl-CuCl-H2O体系中,结晶出一种淡蓝色的物质A,其组成可表示为xNH4Cl·CuCl2·yH2O。称取1.4026g晶体A,溶于水并在250mL容量瓶中定容。Cl-分析:移取25.00mL溶液,加入2滴0.5%荧光黄的乙醇溶液和一滴稀NaOH溶液,再加2mL0.5%淀粉溶液,用0.1036molL-1AgNO3溶液滴定(反应1),至出现粉红色,消耗19.52mL:Cu2+分析:移取25.00mL溶液,加入1molL-1H2SO4溶液5mL,再加固体KI1.5g,混匀并放置(反应2),用0.02864molL-1Na2S2O3溶液滴定(反应3),至棕色较浅时加入2mL0.5%淀粉溶液,继续滴至蓝紫色恰好消失,消耗17.65mL。
(1)写出反应1-3的方程式_____ 。
(2)通过计算确定A中x和y的值。(NH4Cl式量53.49,CuCl2式量134.5)_____ 。
在NH4Cl-CuCl-H2O体系中,结晶出一种淡蓝色的物质A,其组成可表示为xNH4Cl·CuCl2·yH2O。称取1.4026g晶体A,溶于水并在250mL容量瓶中定容。Cl-分析:移取25.00mL溶液,加入2滴0.5%荧光黄的乙醇溶液和一滴稀NaOH溶液,再加2mL0.5%淀粉溶液,用0.1036molL-1AgNO3溶液滴定(反应1),至出现粉红色,消耗19.52mL:Cu2+分析:移取25.00mL溶液,加入1molL-1H2SO4溶液5mL,再加固体KI1.5g,混匀并放置(反应2),用0.02864molL-1Na2S2O3溶液滴定(反应3),至棕色较浅时加入2mL0.5%淀粉溶液,继续滴至蓝紫色恰好消失,消耗17.65mL。
(1)写出反应1-3的方程式
(2)通过计算确定A中x和y的值。(NH4Cl式量53.49,CuCl2式量134.5)
您最近一年使用:0次
4 . 用EDTA配位滴定法可测定与Cu2+和Zn2+共存的Al3+的含量,以PAN为指示剂,测定的相对误差≤±0.1%。测定过程可表述如下(注:表中的配合物电荷数被省略;游离的EDTA的各种形体均被简写为Y):
附:配合物稳定常数的对数值lgK稳的数据:

附:配合物稳定常数的对数值lgK稳的数据:CuY 18. 8 ZnY 16.5 AlY 16. 1 AlF 19.7 Cu- PAN 16.1
19.7 Cu- PAN 16.1
(1)写出从D框状态到E框状态的反应式并配平_______ 。
(2)F框状态内还应存在何种物质_______ ?
(3)是否需确知所用EDTA溶液的准确浓度_______ ?V1是否需要准确读取并记录_______ ?简述原因_______ 。
(4)若从C框状态到D框状态时Cu2+溶液滴过量了,问:
①对最终的测定结果将引入正误差还是负误差?还是无影响_______ ?
②如你认为有影响,在实验方面应如何处理_______ ?
(5)设试液取量V0和V1、V2、V3均以mL为单位,MAl为Al的摩尔质量(g·mol-1),c(EDTA)、c(Cu)分别为EDTA和Cu2+溶液的浓度(mol·L-1),列出试液中Al含量(g·L-1)的计算式_______ 。
附:配合物稳定常数的对数值lgK稳的数据:

附:配合物稳定常数的对数值lgK稳的数据:CuY 18. 8 ZnY 16.5 AlY 16. 1 AlF
 19.7 Cu- PAN 16.1
19.7 Cu- PAN 16.1(1)写出从D框状态到E框状态的反应式并配平
(2)F框状态内还应存在何种物质
(3)是否需确知所用EDTA溶液的准确浓度
(4)若从C框状态到D框状态时Cu2+溶液滴过量了,问:
①对最终的测定结果将引入正误差还是负误差?还是无影响
②如你认为有影响,在实验方面应如何处理
(5)设试液取量V0和V1、V2、V3均以mL为单位,MAl为Al的摩尔质量(g·mol-1),c(EDTA)、c(Cu)分别为EDTA和Cu2+溶液的浓度(mol·L-1),列出试液中Al含量(g·L-1)的计算式
您最近一年使用:0次
解题方法
5 . 有人用酸碱滴定法测定二元弱酸的分子量,实验过程如下:
步骤一:用邻苯二甲酸氢钾标定氢氧化钠,测得氢氧化钠标准溶液的浓度为0.1055mol/L。氢氧化钠标准溶液在未密闭的情况放置两天后(溶剂挥发忽略不计),按照下列方法测定了氢氧化钠标准溶液吸收的CO2的量:移取25.00 mL该标准碱液用0.1152 mol/L的HCl滴定至酚酞变色为终点,消耗HCl标准溶液22.78 mL。
步骤二:称取纯的有机弱酸(H2B)样品0.1963 g。将样品定量溶解在50.00 mL纯水中,选择甲基橙为指示剂进行滴定。当加入新标定的0.0950 mol/L氢氧化钠标准溶液9.21 mL时,发现该法不当,遂停止滴定,用酸度计测定了停止滴定时溶液的pH= 2.87.已知H2B的pKa1= 2.86,pKa2= 5.70。
(1)按步骤一计算放置两天后的氢氧化钠标准溶液每升吸收了多少克CO2____ :
(2)按步骤二估算该二元弱酸 H2B的分子量____ 。
(3)试设计一个 正确的测定该弱酸分子量的滴定分析方法,指明滴定剂、指示剂,并计算化学计量点的pH____ 。
(4)若使用步骤一放置两天后 的氢氧化钠标准溶液用设计的正确方法测定该二元弱酸的分子量,计算由此引起的相对误差____ 。
步骤一:用邻苯二甲酸氢钾标定氢氧化钠,测得氢氧化钠标准溶液的浓度为0.1055mol/L。氢氧化钠标准溶液在未密闭的情况放置两天后(溶剂挥发忽略不计),按照下列方法测定了氢氧化钠标准溶液吸收的CO2的量:移取25.00 mL该标准碱液用0.1152 mol/L的HCl滴定至酚酞变色为终点,消耗HCl标准溶液22.78 mL。
步骤二:称取纯的有机弱酸(H2B)样品0.1963 g。将样品定量溶解在50.00 mL纯水中,选择甲基橙为指示剂进行滴定。当加入新标定的0.0950 mol/L氢氧化钠标准溶液9.21 mL时,发现该法不当,遂停止滴定,用酸度计测定了停止滴定时溶液的pH= 2.87.已知H2B的pKa1= 2.86,pKa2= 5.70。
(1)按步骤一计算放置两天后的氢氧化钠标准溶液每升吸收了多少克CO2
(2)按步骤二估算该二元弱酸 H2B的分子量
(3)试设计一个 正确的测定该弱酸分子量的滴定分析方法,指明滴定剂、指示剂,并计算化学计量点的pH
(4)若使用步骤一放置两天后 的氢氧化钠标准溶液用设计的正确方法测定该二元弱酸的分子量,计算由此引起的相对误差
您最近一年使用:0次
6 . 某铅合金中含有Pb, Bi, Ni等元素,称取此合金试样2.420g,用HNO3溶解并定容至250mL。移取50.00 mL上述试液于250mL锥形瓶中,调节pH=1,以二甲酚橙为指示剂,用0.07500 mol·L-1 EDTA标准溶液滴定,消耗5.25mL。然后,用六次甲基四胺缓冲溶液将pH调至5,再以上述EDTA标准溶液滴定,消耗28.76 mL。加入邻二氨菲,置换出镍配合物中的EDTA, 用0.04500 mol ·L-1Pb(NO3)2标准溶液滴定置换出的EDTA,消耗8.76mL。计算此合金试样中Pb, Bi, Ni的质量分数________ 。(lgKBiY= 27.94, lgKPbY = 18.04, IgKNiY = 18.62)
您最近一年使用:0次
7 . 镍是钢中的重要元素之一,镍的加入可以增加钢的硬度、弹性、延展性和抗腐蚀性。某实验室有两份含Ni钢样,1号钢样中Ni的质量分数为0.362%,2号钢样Ni含量未知。实验人员用过二硫酸铵-丁二酮肟吸光光度法对钢样中Ni含量进行测定:取一定质量的钢样在通风柜中加入适量硝酸,加热溶解,转移至100 mL容量瓶,定容摇匀。移取10.00 mL试样溶液于50 mL容量瓶中,依次加入酒石酸钠、NaOH、丁二酮肟和过二硫酸铵。丁酮肟加入后有浑浊现象,加入过二硫酸铵后溶解成酒红色溶液,再加水定容。
(1)请写出镍溶解及氧化过程中的离子方程式_________ ,并说明酒石酸钠和NaOH的作用_________ 。
(2) 1号钢样经上述分解步骤和显色反应后制备的溶液,利用普通吸光光度法进行检测。使用2 cm吸收池于530 nm处(ε = 6.60 × 103 L·mol-1·cm-1 )测量,欲使测量的相对误差最小,称取1号钢样的质量应为多少_________ ?
(3)请指出(2)中普通吸光光度法使用的参比溶液的组成_________ ,为何使用该溶液作为参比溶液_________ ?
(4)以示差吸光光度法测定2号钢样中Ni含量,称取0.382 g2号钢样,经与测定1号钢样同样步骤配制的溶液,使用2 cm吸收池,波长选择530 nm,以4-2中配制的1号钢样显色反应后的溶液作参比液,并以此调节透射比为100%,此时测得2号钢样显色后溶液的透射比为T= 31.4%,计算2号钢样中Ni的质量分数_________ 。
(1)请写出镍溶解及氧化过程中的离子方程式
(2) 1号钢样经上述分解步骤和显色反应后制备的溶液,利用普通吸光光度法进行检测。使用2 cm吸收池于530 nm处(ε = 6.60 × 103 L·mol-1·cm-1 )测量,欲使测量的相对误差最小,称取1号钢样的质量应为多少
(3)请指出(2)中普通吸光光度法使用的参比溶液的组成
(4)以示差吸光光度法测定2号钢样中Ni含量,称取0.382 g2号钢样,经与测定1号钢样同样步骤配制的溶液,使用2 cm吸收池,波长选择530 nm,以4-2中配制的1号钢样显色反应后的溶液作参比液,并以此调节透射比为100%,此时测得2号钢样显色后溶液的透射比为T= 31.4%,计算2号钢样中Ni的质量分数
您最近一年使用:0次
8 . 化学式为MOxCly的物质有氧化性,M为过渡金属元素,x和y均为正整数。将2.905g样品溶于水,定容至100mL。移取20.00mL溶液,加入稀硝酸和足量AgNO3,分离得到白色沉淀1.436g。移取溶液20.00mL,加入适量硫酸,以N-邻苯基氨基苯甲酸作指示剂,用标准硫酸亚铁铵溶液滴至终点,消耗3.350 mmol。已知其中阳离子以MO 存在,推出该物质的化学式
存在,推出该物质的化学式____ ,指出M是哪种元素____ 。写出硫酸亚铁铵溶液滴定MO 的离子反应方程式
的离子反应方程式____ 。
 存在,推出该物质的化学式
存在,推出该物质的化学式 的离子反应方程式
的离子反应方程式
您最近一年使用:0次
名校
9 . 以0.10mol/L的氢氧化钠溶液滴定同浓度某一元酸HA的滴定曲线如图所示(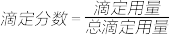 )。下列表述错误的是
)。下列表述错误的是
 )。下列表述错误的是
)。下列表述错误的是
| A.z点后存在某点,溶液中的水的电离程度和y点的相同 |
| B.a约为3.5 |
C.z点处,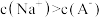 |
D.x点处的溶液中离子满足: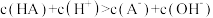 |
您最近一年使用:0次
2019-12-31更新
|
1917次组卷
|
9卷引用:河北省“五个一”名校联盟2020届高三上学期一轮复习收官考试理综化学试题
名校
10 . 在25℃时,向50.00mL未知浓度的氨水中逐滴加入0.5mol·L-1的HCl溶液。滴定过程中,溶液的pOH[pOH=-lgc(OH-)]与滴入HCl溶液体积的关系如图所示,则下列说法中正确的是
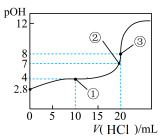
| A.图中②点所示溶液的导电能力弱于①点 |
| B.③点处水电离出的c(H+)=1×10-8mol·L-1 |
| C.图中点①所示溶液中,c(C1-)>c(NH4+)>c(OH-)>c(H+) |
| D.25℃时氨水的Kb约为5×10-5.6mol·L-1 |
您最近一年使用:0次
2019-05-24更新
|
3117次组卷
|
13卷引用:四川省泸县第五中学2020届高三上学期开学考试理综化学试题
四川省泸县第五中学2020届高三上学期开学考试理综化学试题备考突破2020高三化学专题强化集训——盐类水解中三大守恒的应用安徽省定远县重点中学2020届高三下学期3月线上模拟考试理科综合化学试题湖南省长沙市湖南师范大学附属中学2022-2023学年高二上学期期末考试化学试题 湖南师范大学附属中学2022-2023学年高二上学期期末考试化学试题山西省实验中学2023-2024学年高二上学期期中考试化学试题四川省绵阳中学2023-2024学年高二下学期开学化学试题四川省达州外国语学校2023-2024学年高二下学期3月月考化学试题【市级联考】山东省烟台市、菏泽市2019届高三下学期5月高考适应性练习(一)理科综合化学试题黑龙江省齐齐哈尔市2023-2024学年高二上学期1月期末化学试题江西省宜春市上高中学2023-2024学年高二上学期第二次月考化学试卷 黑龙江省双鸭山市第一中学2023-2024学年高二下学期开学化学试题2024年江西省宜春市第一中学高三下学期第三次模拟考试化学试卷



