名校
1 . 二氧化铈( )具有较强的氧化性,是一种应用非常广泛的稀土氧化物。以氟碳铈矿(主要含
)具有较强的氧化性,是一种应用非常广泛的稀土氧化物。以氟碳铈矿(主要含 、
、 等)为原料制备
等)为原料制备 的一种工艺流程如图所示。
的一种工艺流程如图所示。
(1)“氧化焙烧”后,Ce元素转化为 和
和 ,写出氧化焙烧的化学方程式
,写出氧化焙烧的化学方程式_______ 。
(2)“酸浸”时,铈的浸出率与温度、 的关系如图所示,应选择的最适宜的条件为
的关系如图所示,应选择的最适宜的条件为_______ (填标号)。不能用盐酸代替硫酸进行酸浸,理由是_______ 。 B.75℃、
B.75℃、 C.85℃、
C.85℃、 D.100℃、
D.100℃、
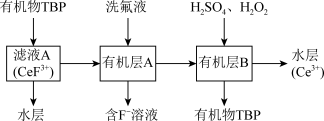
(3)“系列操作”包含以下几个过程: 不能溶于有机物TBP,
不能溶于有机物TBP,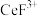 能溶于有机物TBP,且存在反应
能溶于有机物TBP,且存在反应 。
。
“系列操作”在_______ (填仪器名称)中完成,“有机层B”中发生反应的离子方程式为_______ 。
(4)“调pH”中,要使 沉淀完全(通常认为溶液中离子浓度小于
沉淀完全(通常认为溶液中离子浓度小于 为沉淀完全),应控制pH大于
为沉淀完全),应控制pH大于_______ (已知:25℃时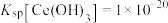 )。
)。
(5)“氧化”中,氧化剂与还原剂的物质的量之比为_______ 。
(6) 具有良好的储氧放氧能力,晶胞如图所示,是汽车尾气净化催化剂的关键成分。
具有良好的储氧放氧能力,晶胞如图所示,是汽车尾气净化催化剂的关键成分。 中位于晶粒表面的
中位于晶粒表面的 具有催化作用。已知
具有催化作用。已知 晶胞边长为
晶胞边长为 ,在边长为
,在边长为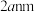 的立方体晶粒中位于表面的
的立方体晶粒中位于表面的 最多有
最多有_______ 个。
②在尾气消除过程中 与
与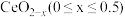 相互转化。
相互转化。 中的Ce为
中的Ce为 、
、 价,测定x的值可判断它们的比例。现取
价,测定x的值可判断它们的比例。现取 固体1.6560g,加入足量硫酸和
固体1.6560g,加入足量硫酸和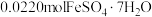 充分溶解,使
充分溶解,使 ⁺全部被还原成
⁺全部被还原成 ,再用
,再用 的酸性
的酸性 标准溶液滴定至终点,重复操作三次,平均消耗标准溶液40.00mL(已知氧化性:
标准溶液滴定至终点,重复操作三次,平均消耗标准溶液40.00mL(已知氧化性: ),则x的值为
),则x的值为_______ ,则此时氧空位率为_______ 。
 )具有较强的氧化性,是一种应用非常广泛的稀土氧化物。以氟碳铈矿(主要含
)具有较强的氧化性,是一种应用非常广泛的稀土氧化物。以氟碳铈矿(主要含 、
、 等)为原料制备
等)为原料制备 的一种工艺流程如图所示。
的一种工艺流程如图所示。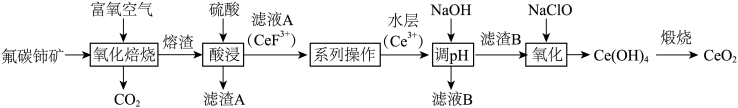
(1)“氧化焙烧”后,Ce元素转化为
 和
和 ,写出氧化焙烧的化学方程式
,写出氧化焙烧的化学方程式(2)“酸浸”时,铈的浸出率与温度、
 的关系如图所示,应选择的最适宜的条件为
的关系如图所示,应选择的最适宜的条件为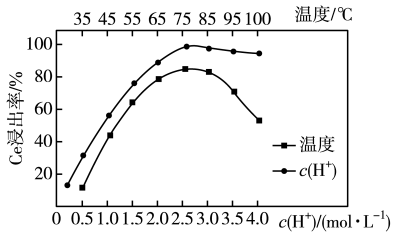
 B.75℃、
B.75℃、 C.85℃、
C.85℃、 D.100℃、
D.100℃、
(3)“系列操作”包含以下几个过程:
 不能溶于有机物TBP,
不能溶于有机物TBP,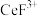 能溶于有机物TBP,且存在反应
能溶于有机物TBP,且存在反应 。
。“系列操作”在
(4)“调pH”中,要使
 沉淀完全(通常认为溶液中离子浓度小于
沉淀完全(通常认为溶液中离子浓度小于 为沉淀完全),应控制pH大于
为沉淀完全),应控制pH大于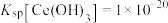 )。
)。(5)“氧化”中,氧化剂与还原剂的物质的量之比为
(6)
 具有良好的储氧放氧能力,晶胞如图所示,是汽车尾气净化催化剂的关键成分。
具有良好的储氧放氧能力,晶胞如图所示,是汽车尾气净化催化剂的关键成分。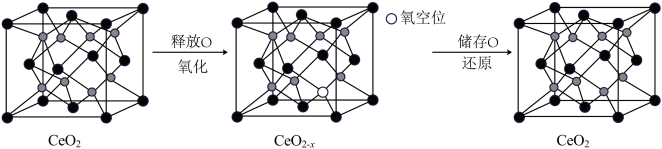
 中位于晶粒表面的
中位于晶粒表面的 具有催化作用。已知
具有催化作用。已知 晶胞边长为
晶胞边长为 ,在边长为
,在边长为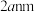 的立方体晶粒中位于表面的
的立方体晶粒中位于表面的 最多有
最多有②在尾气消除过程中
 与
与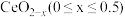 相互转化。
相互转化。 中的Ce为
中的Ce为 、
、 价,测定x的值可判断它们的比例。现取
价,测定x的值可判断它们的比例。现取 固体1.6560g,加入足量硫酸和
固体1.6560g,加入足量硫酸和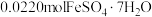 充分溶解,使
充分溶解,使 ⁺全部被还原成
⁺全部被还原成 ,再用
,再用 的酸性
的酸性 标准溶液滴定至终点,重复操作三次,平均消耗标准溶液40.00mL(已知氧化性:
标准溶液滴定至终点,重复操作三次,平均消耗标准溶液40.00mL(已知氧化性: ),则x的值为
),则x的值为
您最近一年使用:0次
名校
解题方法
2 . 以某菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料通过以下方法可获得碳酸锰粗产品。
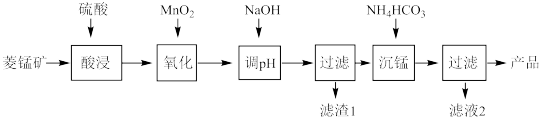
(已知:Ksp(MnCO3) = 2.2×10−11,Ksp[Mn(OH)2] = 1.9×10−13,Ksp[Al(OH)3] = 1.3×10−33)
(1)滤渣1中,含铁元素的物质主要是_______ (填化学式,下同);加NaOH调节溶液的pH约为5,如果pH过大,可能导致滤渣1中_______ 含量减少。
(2)滤液2中,+1价阳离子除了H+外还有_________ (填离子符号)。
(3)取“沉锰”前溶液amL于锥形瓶中,加入少量AgNO3溶液(作催化剂)和过量的1.5%(NH4)2S2O8溶液,加热,Mn2+被氧化为MnO4−,反应一段时间后再煮沸5min[除去过量的(NH4)2S2O8],冷却至室温。选用适宜的指示剂,用b mol·L−1的(NH4)2Fe(SO4)标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2标准溶液V mL。
① Mn2+与(NH4)2S2O8反应的还原产物为____________ (填化学式)。
② “沉锰”前溶液中c(Mn2+) =___________ mol·L−1(列出表达式)。
(4)其他条件不变,“沉锰”过程中锰元素回收率与NH4HCO3初始浓度(c0)、反应时间的关系如下图所示。
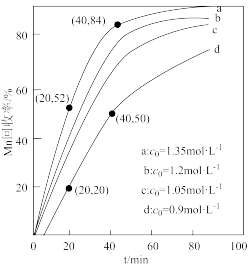
①NH4HCO3初始浓度越大,锰元素回收率越___ (填“高”或“低”),简述原因_______ 。
② 若溶液中c(Mn2+) =1.0 mol·L−1,加入等体积1.8 mol·L−1 NH4HCO3溶液进行反应,计算20~40 min内v(Mn2+) =_________ mol·L−1·min−1。

(已知:Ksp(MnCO3) = 2.2×10−11,Ksp[Mn(OH)2] = 1.9×10−13,Ksp[Al(OH)3] = 1.3×10−33)
(1)滤渣1中,含铁元素的物质主要是
(2)滤液2中,+1价阳离子除了H+外还有
(3)取“沉锰”前溶液amL于锥形瓶中,加入少量AgNO3溶液(作催化剂)和过量的1.5%(NH4)2S2O8溶液,加热,Mn2+被氧化为MnO4−,反应一段时间后再煮沸5min[除去过量的(NH4)2S2O8],冷却至室温。选用适宜的指示剂,用b mol·L−1的(NH4)2Fe(SO4)标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2标准溶液V mL。
① Mn2+与(NH4)2S2O8反应的还原产物为
② “沉锰”前溶液中c(Mn2+) =
(4)其他条件不变,“沉锰”过程中锰元素回收率与NH4HCO3初始浓度(c0)、反应时间的关系如下图所示。

①NH4HCO3初始浓度越大,锰元素回收率越
② 若溶液中c(Mn2+) =1.0 mol·L−1,加入等体积1.8 mol·L−1 NH4HCO3溶液进行反应,计算20~40 min内v(Mn2+) =
您最近一年使用:0次
2016-12-09更新
|
753次组卷
|
3卷引用:2016届福建省高中毕业班4月质量检查考试理综化学试卷



