名校
1 . 无水FeCl2为黄绿色晶体,在空气中易被氧化和易吸水,不溶于氯仿等有机溶剂。回答下列问题:
I.FeCl2的制备及产率测定:制备反应原理为2FeCl3+C6H5Cl 2FeCl2+C6H4Cl2+HCl(C6H5Cl为氯苯,沸点132℃),产率通过测定HCl的量进行计算。制备装置如图所示(夹持及加热装置略去):
2FeCl2+C6H4Cl2+HCl(C6H5Cl为氯苯,沸点132℃),产率通过测定HCl的量进行计算。制备装置如图所示(夹持及加热装置略去):
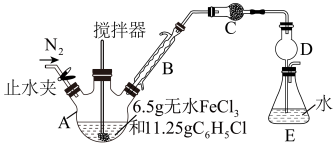
(1)仪器A的名称是____ ,仪器B的作用是____ ,装置C中的试剂是____ (填化学式)。
(2)为测定FeCl2的产率,用1.00mol·L-1NaOH溶液滴定溶于水的HCl,达到滴定终点时消耗NaOH溶液19.00mL,则FeCl2的产率为____ 。下列操作中,导致产率测定值偏低的是____ 。
a.滴定终点时俯视读数
b.滴定管未用NaOH标准溶液润洗
c.配制NaOH标准溶液时,转移溶液未洗涤烧杯
d.滴定前滴定管内无气泡,滴定结束后有气泡
II.FeCl2性质探究:将FeCl2晶体配成溶液后进行如表实验。
已知:Ba2+与SCN-可在溶液中大量共存;SCN-易被氧化为SO 。
。
(3)对实验ⅰ中溶液为浅红色的原因,甲同学提出以下假设:
假设1:加入氯水的量少,生成的Fe3+浓度低;
假设2:氯水氧化性强,____ 。
取实验ⅰ中浅红色溶液,____ (填实验操作),溶液浅红色消失,从而排除了假设1;向2mL水中滴加0.5mL0.1mol·L-1KSCN溶液,滴加0.5mL饱和氯水,加入____ ,产生白色沉淀,说明假设2正确。
(4)分析实验ⅱ“一段时间后,溶液褪为无色”的原因是____ (用离子方程式表示,已知SCN-中C元素为+4价)。
I.FeCl2的制备及产率测定:制备反应原理为2FeCl3+C6H5Cl
 2FeCl2+C6H4Cl2+HCl(C6H5Cl为氯苯,沸点132℃),产率通过测定HCl的量进行计算。制备装置如图所示(夹持及加热装置略去):
2FeCl2+C6H4Cl2+HCl(C6H5Cl为氯苯,沸点132℃),产率通过测定HCl的量进行计算。制备装置如图所示(夹持及加热装置略去):
(1)仪器A的名称是
(2)为测定FeCl2的产率,用1.00mol·L-1NaOH溶液滴定溶于水的HCl,达到滴定终点时消耗NaOH溶液19.00mL,则FeCl2的产率为
a.滴定终点时俯视读数
b.滴定管未用NaOH标准溶液润洗
c.配制NaOH标准溶液时,转移溶液未洗涤烧杯
d.滴定前滴定管内无气泡,滴定结束后有气泡
II.FeCl2性质探究:将FeCl2晶体配成溶液后进行如表实验。
| 序号 | 装置 | 试剂 | 实验现象 | |
| 实验ⅰ |  | 0.5mL0.1mol·L-1 KSCN溶液、1mL0.1mol·L-1 FeCl2(pH=1)溶液 | 0.5mL饱和氯水 | 溶液立即变为浅红色 |
| 实验ⅱ | 1mLl.5mol·L-1 HNO3溶液 | 滴入硝酸后,溶液变为红色,一段时间后,溶液褪为无色,且溶液中产生无色气泡,试管上方呈红棕色。 | ||
 。
。(3)对实验ⅰ中溶液为浅红色的原因,甲同学提出以下假设:
假设1:加入氯水的量少,生成的Fe3+浓度低;
假设2:氯水氧化性强,
取实验ⅰ中浅红色溶液,
(4)分析实验ⅱ“一段时间后,溶液褪为无色”的原因是
您最近一年使用:0次
2022-05-11更新
|
483次组卷
|
3卷引用:湖南省益阳市第一中学2021-2022学年高二下学期期末考试化学试题
名校
解题方法
2 . 砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
(1)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O5分解为As2O3的热化学方程式_________________ 。
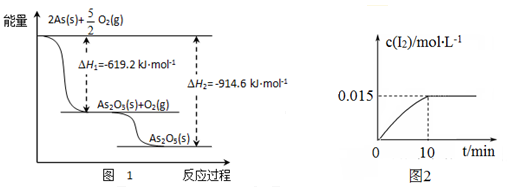
(2)砷酸钠具有氧化性,298 K时,在100 mL烧杯中加入10 mL 0.1 mol/L Na3AsO4溶液、20 mL 0.1 mol/L KI溶液和20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+ AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
①下列情况表明上述可逆反应达到平衡状态的是_______ (填字母代号)。
a.溶液颜色保持不再变化 b.c(AsO33-)+c(AsO43-)不再变化
c.AsO43-的生成速率等于I2的生成速率 d. 保持不再变化
保持不再变化
②0~10 min内,I−的反应速率v(I−)=_______ 。
③在该条件下,上述反应的平衡常数K=______ 。
④升高温度,溶液中AsO43-的平衡转化率减小,则该反应的 ΔH______ 0(填“大于”“小于”或“等于”)。
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样0.2000 g溶于NaOH溶液,得到含AsO33-和AsO43-的混合溶液。
②上述混合液用0.02500 mol•L-1的I2溶液滴定,用____ 做指示剂进行滴定。重复滴定2次,平均消耗I2溶液40.00 mL。则试样中As2O5的质量分数是______ 。
(4)雄黄(As4S4)在空气中加热至300℃时会生成两种氧化物,其中一种氧化物为剧毒的砒霜(As2O3),另一种氧化物为______ (填化学式),可用双氧水将As2O3氧化为H3AsO4而除去,写出该反应的化学方程式_________ 。
(1)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O5分解为As2O3的热化学方程式

(2)砷酸钠具有氧化性,298 K时,在100 mL烧杯中加入10 mL 0.1 mol/L Na3AsO4溶液、20 mL 0.1 mol/L KI溶液和20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+
 AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。①下列情况表明上述可逆反应达到平衡状态的是
a.溶液颜色保持不再变化 b.c(AsO33-)+c(AsO43-)不再变化
c.AsO43-的生成速率等于I2的生成速率 d.
 保持不再变化
保持不再变化②0~10 min内,I−的反应速率v(I−)=
③在该条件下,上述反应的平衡常数K=
④升高温度,溶液中AsO43-的平衡转化率减小,则该反应的 ΔH
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样0.2000 g溶于NaOH溶液,得到含AsO33-和AsO43-的混合溶液。
②上述混合液用0.02500 mol•L-1的I2溶液滴定,用
(4)雄黄(As4S4)在空气中加热至300℃时会生成两种氧化物,其中一种氧化物为剧毒的砒霜(As2O3),另一种氧化物为
您最近一年使用:0次
2017-05-29更新
|
649次组卷
|
5卷引用:湖南省邵阳市洞口县第一中学2018届高三上学期第一次月考理科综合化学试题



