名校
解题方法
1 . 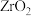 常用作陶瓷材料,可由锆英砂(主要成分为
常用作陶瓷材料,可由锆英砂(主要成分为 ,也可表示为
,也可表示为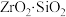 ,还含少量
,还含少量 等杂质)通过如图方法制取。
等杂质)通过如图方法制取。

已知:①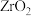 能与烧碱反应生成可溶于水的
能与烧碱反应生成可溶于水的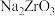 ,
,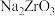 与酸反应生成
与酸反应生成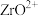 。
。
②部分金属离子在实验条件下开始沉淀和完全沉淀的 如表。
如表。
(1)熔融时 发生反应的化学方程式为
发生反应的化学方程式为_______ ,滤渣Ⅰ的化学式为_______ 。
(2)滤液Ⅰ中除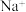 外还含金属的阳离子有
外还含金属的阳离子有_______ ,为使滤液Ⅰ的杂质离子沉淀完全,需用氨水调 ,则a的范围是
,则a的范围是_______ 。
(3)继续加氨水至 时,所发生反应的离子方程式为
时,所发生反应的离子方程式为_______ 。
(4)向过滤Ⅲ所得滤液中加入 粉末并加热,得到两种气体。该反应的离子方程式为
粉末并加热,得到两种气体。该反应的离子方程式为_______ 。
(5)为得到纯净的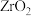 ,
,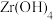 需要洗涤,检验
需要洗涤,检验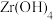 是否洗涤干净的方法是
是否洗涤干净的方法是_______ 。
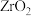 常用作陶瓷材料,可由锆英砂(主要成分为
常用作陶瓷材料,可由锆英砂(主要成分为 ,也可表示为
,也可表示为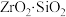 ,还含少量
,还含少量 等杂质)通过如图方法制取。
等杂质)通过如图方法制取。
已知:①
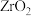 能与烧碱反应生成可溶于水的
能与烧碱反应生成可溶于水的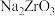 ,
,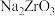 与酸反应生成
与酸反应生成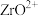 。
。②部分金属离子在实验条件下开始沉淀和完全沉淀的
 如表。
如表。| 金属离子 |  | 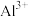 | 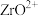 |
开始沉淀时 | 1.9 | 3.3 | 6.2 |
沉淀完全时 | 3.2 | 5.2 | 8.0 |
 发生反应的化学方程式为
发生反应的化学方程式为(2)滤液Ⅰ中除
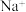 外还含金属的阳离子有
外还含金属的阳离子有 ,则a的范围是
,则a的范围是(3)继续加氨水至
 时,所发生反应的离子方程式为
时,所发生反应的离子方程式为(4)向过滤Ⅲ所得滤液中加入
 粉末并加热,得到两种气体。该反应的离子方程式为
粉末并加热,得到两种气体。该反应的离子方程式为(5)为得到纯净的
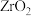 ,
,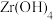 需要洗涤,检验
需要洗涤,检验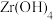 是否洗涤干净的方法是
是否洗涤干净的方法是
您最近一年使用:0次
名校
2 . 下列说法正确的是
A.向氢氟酸溶液中适当加热或加水,均能使溶液中 增大 增大 |
B.室温下,向 悬浊液中加少量水,达到新平衡后 悬浊液中加少量水,达到新平衡后 浓度减小 浓度减小 |
C.100℃时,将 的硫酸与 的硫酸与 的 的 等体积混合后,溶液显中性 等体积混合后,溶液显中性 |
D.为除去 酸性溶液中混有的 酸性溶液中混有的 杂质,可加入 杂质,可加入 溶液充分反应后过滤 溶液充分反应后过滤 |
您最近一年使用:0次
3 . 严谨的实验设计能有效规避实验风险,能重复实验并得到相同的结果。由粗盐制备试剂级的NaCl的相关实验步骤和装置如下:
【粗盐的提纯】
第I步:称取20.0g粗盐(含MgCl2、CaCl2、Na2SO4杂质),用80mL水溶解,加入1.0mol/L BaCl2至观察不到明显沉淀为止,用倾析法分离,保留滤液。
第II步:向滤液中先后加入过量2.0mol/L NaOH、1.0mol/L Na2CO3,过滤,再用3.0mol/L HCl调节pH至1~2。
第III步,加热浓缩至溶液刚刚出现微晶膜。
(1)第I步加入BaCl2时,证明SO 已经除净的实验方法是
已经除净的实验方法是___________ 。
(2)第II步加入Na2CO3可以除去的离子为___________ 。
(3)第III步加热浓缩时所用到的硅酸盐材质的仪器有酒精灯、___________ ;已知:Ksp(BaCO3)=5.0×10-9、Ksp(BaSO4)=1.1×10-10;如果省略第I步“倾析法分离”,所得氯化钠溶液的纯度将___________ (填“升高”、“降低”或“不受影响”)。
【试剂级的NaCl的制备】
第IV步,将第III步浓缩溶液转移至下图装置C中继续实验。
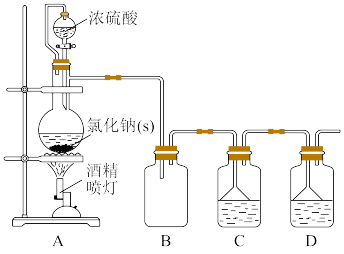
(4)装置A中发生的化学反应方程式为___________ ,控制该反应速率可采取的措施___________ (任答一点即可)。
(5)装置B中的广口瓶和装置C、D中的漏斗,其共同作用是___________ ,装置C的溶液中能观察到的实验现象是___________ 。装置D中盛放的试剂为___________ (填“NaOH溶液”、“NaHSO3溶液”或“浓H2SO4”)。
【粗盐的提纯】
第I步:称取20.0g粗盐(含MgCl2、CaCl2、Na2SO4杂质),用80mL水溶解,加入1.0mol/L BaCl2至观察不到明显沉淀为止,用倾析法分离,保留滤液。
第II步:向滤液中先后加入过量2.0mol/L NaOH、1.0mol/L Na2CO3,过滤,再用3.0mol/L HCl调节pH至1~2。
第III步,加热浓缩至溶液刚刚出现微晶膜。
(1)第I步加入BaCl2时,证明SO
 已经除净的实验方法是
已经除净的实验方法是(2)第II步加入Na2CO3可以除去的离子为
(3)第III步加热浓缩时所用到的硅酸盐材质的仪器有酒精灯、
【试剂级的NaCl的制备】
第IV步,将第III步浓缩溶液转移至下图装置C中继续实验。

(4)装置A中发生的化学反应方程式为
(5)装置B中的广口瓶和装置C、D中的漏斗,其共同作用是
您最近一年使用:0次
2022-03-25更新
|
506次组卷
|
5卷引用:四川省内江市2022届高三下学期第二次模拟考试理科综合化学试题



