1 . 硫氰化钾 是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图所示的实验装置模拟工业制备
是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图所示的实验装置模拟工业制备 并进行相关探究实验。
并进行相关探究实验。

已知:① 是一种不溶于水且密度大于水的非极性试剂;
是一种不溶于水且密度大于水的非极性试剂;
② 。
。
请回答下列问题:
(1) 的电子式为
的电子式为___________ 。
(2)装置A用于实验室制备氨气,该反应的化学方程式为___________ 。
(3)装置B中,三口烧瓶内盛有 、水和固体催化剂,通入氨气的导管需要插入
、水和固体催化剂,通入氨气的导管需要插入 液体中,其目的是
液体中,其目的是___________ 。
(4)待三口烧瓶内液体不再分层时,熄灭装置A处的酒精灯,关闭 ,移开水浴。将装置B继续加热至
,移开水浴。将装置B继续加热至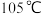 ,待
,待 完全分解后,打开
完全分解后,打开 ,缓缓滴入适量
,缓缓滴入适量 溶液,充分反应后制得
溶液,充分反应后制得 溶液。装置C中仪器a的名称为
溶液。装置C中仪器a的名称为___________ ,装置C处的烧杯中产生淡黄色浑浊的原因是___________ (用离子方程式表示)。
(5)过滤装置C中吸收尾气后的悬浊液,得到滤液x。现取少量滤液x进行如图所示的探究实验。
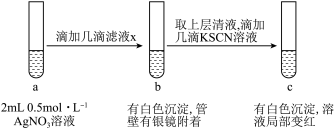
已知: 。
。
①试管b中产生银镜的原因是___________ (用离子方程式表示)。
②观察到试管c中出现上述实验现象后,用力振荡试管c,又观察到红色褪去且白色沉淀增多,结合平衡移动的知识解释其原因___________ 。
 是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图所示的实验装置模拟工业制备
是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图所示的实验装置模拟工业制备 并进行相关探究实验。
并进行相关探究实验。
已知:①
 是一种不溶于水且密度大于水的非极性试剂;
是一种不溶于水且密度大于水的非极性试剂;②
 。
。请回答下列问题:
(1)
 的电子式为
的电子式为(2)装置A用于实验室制备氨气,该反应的化学方程式为
(3)装置B中,三口烧瓶内盛有
 、水和固体催化剂,通入氨气的导管需要插入
、水和固体催化剂,通入氨气的导管需要插入 液体中,其目的是
液体中,其目的是(4)待三口烧瓶内液体不再分层时,熄灭装置A处的酒精灯,关闭
 ,移开水浴。将装置B继续加热至
,移开水浴。将装置B继续加热至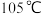 ,待
,待 完全分解后,打开
完全分解后,打开 ,缓缓滴入适量
,缓缓滴入适量 溶液,充分反应后制得
溶液,充分反应后制得 溶液。装置C中仪器a的名称为
溶液。装置C中仪器a的名称为(5)过滤装置C中吸收尾气后的悬浊液,得到滤液x。现取少量滤液x进行如图所示的探究实验。

已知:
 。
。①试管b中产生银镜的原因是
②观察到试管c中出现上述实验现象后,用力振荡试管c,又观察到红色褪去且白色沉淀增多,结合平衡移动的知识解释其原因
您最近一年使用:0次
名校
解题方法
2 . 铊(Tl)在工业中的用途非常广泛,其中铊锡合金可作超导材料:铊镉合金是原子能工业中的重要材料。铊主要从铅精矿焙烧产生的富铊灰(主要成分PbO、ZnO、Fe2O3、 FeO、Tl2O等)中提炼,具体工艺流程如图。
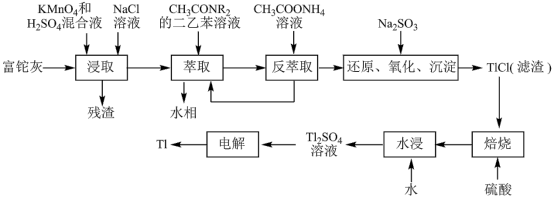
已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H+ +CH3CONR2+TlCl
 [CH3CONR2H]TlCl4。
[CH3CONR2H]TlCl4。
回答下列问题:
(1)浸取过程中硫酸的作用除了酸化提供H+,另一作用为_______ 。
(2)在实验室中,“萃取”过程使用的玻璃仪器有_______ ,用平衡移动解释“反萃取”过程的原理和目的_______ 。
(3)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为_______ ,为提高经济效益充分利用原料,该反应的滤液可加入_______ 步骤循环使用最合适。
(4)Tl+对人体毒性很大,难溶盐KFe[Fe(CN)6]可通过离子交换治疗Tl2SO4中毒,将其转化为沉淀同时生成K2SO4溶液,写出治疗Tl2SO4中毒的离子方程式:_______ 。
(5)电解Tl2SO4溶液制备金属Tl的装置如图所示。石墨(C)上电极反应式为_______ 。


已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H+ +CH3CONR2+TlCl

 [CH3CONR2H]TlCl4。
[CH3CONR2H]TlCl4。回答下列问题:
(1)浸取过程中硫酸的作用除了酸化提供H+,另一作用为
(2)在实验室中,“萃取”过程使用的玻璃仪器有
(3)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为
(4)Tl+对人体毒性很大,难溶盐KFe[Fe(CN)6]可通过离子交换治疗Tl2SO4中毒,将其转化为沉淀同时生成K2SO4溶液,写出治疗Tl2SO4中毒的离子方程式:
(5)电解Tl2SO4溶液制备金属Tl的装置如图所示。石墨(C)上电极反应式为

您最近一年使用:0次
2022-04-10更新
|
765次组卷
|
2卷引用:江西省八所重点中学2022届高三联考理科综合化学试题
3 . 亚磷酸钠(Na2HPO3)用途广泛,也是一种性价比高的催化剂。“NaH2PO2还原法”制备高纯度氢碘酸和亚磷酸钠(Na2HPO3)的工业流程如图如下:

“合成”过程中主要氧化产物为亚磷酸(H3PO3),相应的化学方程式为:NaH2PO2+I2+H2O=H3PO3+NaI+HI。
已知:亚磷酸(H3PO3)为二元酸,其电离常数K1=3.7×l0-2,K2=2.9×l0-7;180℃分解为PH3和磷酸。请回答:
(1)“除铅”过程中,用FeS固体除去微量Pb2+的离子方程式为_______ 。
(2)采取减压蒸馏的原因是_______ 。
(3)“减压蒸馏”过程,I-的回收率为95%,则剩余固体的主要成分为_______ (填化学式),发生反应的化学方程式为_______ 。
(4)“调pH=11”的作用有两个,一是将Fe3+转化为Fe(OH)3沉淀,二是_______ 。
(5)工业上常用电解法制备亚磷酸,其装置示意图如下。

①b为电源的_______ (填“正极”或“负极”)。
②A膜应选择_______ (填“阴离子”或“阳离子”)交换膜。
③阴极的电极反应式为_______ 。

“合成”过程中主要氧化产物为亚磷酸(H3PO3),相应的化学方程式为:NaH2PO2+I2+H2O=H3PO3+NaI+HI。
已知:亚磷酸(H3PO3)为二元酸,其电离常数K1=3.7×l0-2,K2=2.9×l0-7;180℃分解为PH3和磷酸。请回答:
(1)“除铅”过程中,用FeS固体除去微量Pb2+的离子方程式为
(2)采取减压蒸馏的原因是
(3)“减压蒸馏”过程,I-的回收率为95%,则剩余固体的主要成分为
(4)“调pH=11”的作用有两个,一是将Fe3+转化为Fe(OH)3沉淀,二是
(5)工业上常用电解法制备亚磷酸,其装置示意图如下。

①b为电源的
②A膜应选择
③阴极的电极反应式为
您最近一年使用:0次
2021-03-13更新
|
459次组卷
|
2卷引用:广东省韶关市2021届高三综合测试化学试题



