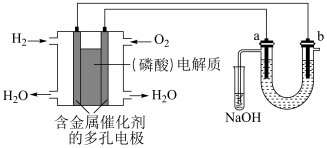
1 . 用酸性氢氧燃料电池电解苦卤水 含
含 、
、 、
、 、
、 )的装置如图所示(
)的装置如图所示( 、
、 为石墨电极)。下列说法中,正确的是
为石墨电极)。下列说法中,正确的是
 含
含 、
、 、
、 、
、 )的装置如图所示(
)的装置如图所示( 、
、 为石墨电极)。下列说法中,正确的是
为石墨电极)。下列说法中,正确的是
A.电池工作时,正极反应式为: |
B.忽略能量损耗,当电池中消耗 时, 时, 极为阳极,理论上周围会产生 极为阳极,理论上周围会产生 |
C.电解时,电子流动路径是:负极 外电路 外电路 阴极 阴极 溶液 溶液 阳极 阳极 正极 正极 |
D.电解时, 电极周围首先放电的是 电极周围首先放电的是 而不是 而不是 ,说明当其他条件相同时前者的还原性强于后者 ,说明当其他条件相同时前者的还原性强于后者 |
您最近一年使用:0次
2020高三·全国·专题练习
名校
解题方法
2 . 普通锌锰干电池的简图如图所示,它是用锌皮制成的锌筒作为电极,中央插一根石墨棒,石墨棒顶端加一铜帽。在石墨棒周围填满二氧化锰和炭黑的混合物,并用离子可以通过的长纤维纸包裹作隔膜,隔膜外是用氯化锌、氯化铵和淀粉等调成糊状作电解质溶液。该电池工作时的总反应为Zn+2NH +2MnO2= [Zn(NH3)2]2++2MnO(OH)。下列关于锌锰干电池的说法中正确的是
+2MnO2= [Zn(NH3)2]2++2MnO(OH)。下列关于锌锰干电池的说法中正确的是
 +2MnO2= [Zn(NH3)2]2++2MnO(OH)。下列关于锌锰干电池的说法中正确的是
+2MnO2= [Zn(NH3)2]2++2MnO(OH)。下列关于锌锰干电池的说法中正确的是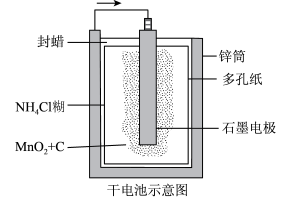
| A.当该电池电压逐渐下降后,利用电解原理能重新充电复原 |
B.电池负极反应为2MnO2+2NH +2e-=Mn2O3+2NH3+H2O +2e-=Mn2O3+2NH3+H2O |
| C.原电池工作时,电子从负极通过外电路流向正极 |
| D.外电路中每通过0.1 mol 电子,锌的质量理论上减少6.5 g |
您最近一年使用:0次
2023-05-13更新
|
281次组卷
|
10卷引用:陕西省渭南市白水中学2022-2023学年高二上学期12月月考化学试题
陕西省渭南市白水中学2022-2023学年高二上学期12月月考化学试题(已下线)专题6.2 原电池 化学电源(讲)——2020年高考化学一轮复习讲练测(已下线)第四章 化学反应与电能(B卷能力提高篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)第一节 原电池 第2课时 化学电源河南省洛阳市宜阳县第一高级中学2022-2023学年高二上学期第五次能力达标测试化学试题辽宁省辽阳市第二高级中学2022-2023学年高二上学期12月月考化学试题四川省眉山市仁寿县2022-2023学年高一下学期5月期中联考化学试题新疆塔城地区塔城市2022-2023学年高二上学期11月期中考试化学试题河南省焦作市第十一中学2023-2024学年高二上学期12月份月考 化学试卷6.1.2 化学反应与电能 随堂练习
3 . 回答下列问题:
(1)①反应 过程中的能量变化如图所示,该反应
过程中的能量变化如图所示,该反应
_______  (用含
(用含 、
、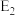 式子表示)。
式子表示)。

②在容积固定的密闭绝热容器中发生上述可逆反应,能证明该可逆反应达到平衡状态的依据是_______
A.混合气体的密度保持不变
B.混合气体的平均摩尔质量保持不变
C.容器内的温度保持不变
D.达到平衡时
E.达到平衡状态时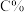 保持不变
保持不变
F.混合气体的总压强不变
(2)符合某些特征的化学反应理论上都可以设计成原电池。下列化学反应_______(填字母)不能设计成原电池。
(3)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入 和
和 ,电解
,电解 溶液。某研究小组以甲烷燃料电池(装置甲)为电源,模拟氯碱工业生产原理,装置如图所示。
溶液。某研究小组以甲烷燃料电池(装置甲)为电源,模拟氯碱工业生产原理,装置如图所示。

请回答以下问题:
①观察到C极和D极不同的现象是_______
②C极可以选用的材料是_______ (填标号)。
A.铁棒 B.铂片 C.铜棒 D.石墨棒
③A极发生的电极反应为_______
④装置甲、乙中的电解质溶液足量,当电路中通过 电子时,理论上得到的气体c在标准状况下的体积为
电子时,理论上得到的气体c在标准状况下的体积为_______ ;此时气体a、b的总物质的量与气体c、d的总物质的量之比为_______ 。
(1)①反应
 过程中的能量变化如图所示,该反应
过程中的能量变化如图所示,该反应
 (用含
(用含 、
、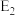 式子表示)。
式子表示)。
②在容积固定的密闭绝热容器中发生上述可逆反应,能证明该可逆反应达到平衡状态的依据是
A.混合气体的密度保持不变
B.混合气体的平均摩尔质量保持不变
C.容器内的温度保持不变
D.达到平衡时

E.达到平衡状态时
 保持不变
保持不变F.混合气体的总压强不变
(2)符合某些特征的化学反应理论上都可以设计成原电池。下列化学反应_______(填字母)不能设计成原电池。
A.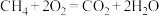 | B. |
C. | D. |
 和
和 ,电解
,电解 溶液。某研究小组以甲烷燃料电池(装置甲)为电源,模拟氯碱工业生产原理,装置如图所示。
溶液。某研究小组以甲烷燃料电池(装置甲)为电源,模拟氯碱工业生产原理,装置如图所示。
请回答以下问题:
①观察到C极和D极不同的现象是
②C极可以选用的材料是
A.铁棒 B.铂片 C.铜棒 D.石墨棒
③A极发生的电极反应为
④装置甲、乙中的电解质溶液足量,当电路中通过
 电子时,理论上得到的气体c在标准状况下的体积为
电子时,理论上得到的气体c在标准状况下的体积为
您最近一年使用:0次
解题方法
4 . 研究青铜器在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义。如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图,下列说法不正确的是
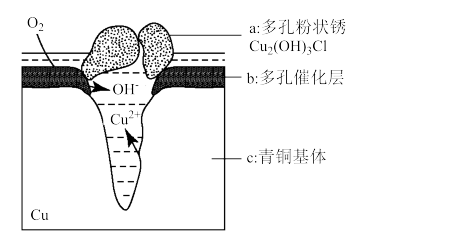

| A.青铜器发生电化学腐蚀,图中c被氧化 |
B.正极反应式为 |
C.环境中的Cl-与正、负极反应的产物作用生成Cu2(OH)3Cl的离子方程式为 |
| D.若生成0.2 mol Cu2(OH)3Cl,则理论上消耗O2的质量为3.2 g |
您最近一年使用:0次
5 . 电解原理在生产生活中应用广泛,回答下列问题:
(1)为防止铁器被腐蚀,常用电解法在其表面镀铜,此时铁器应与电源_________ (填“正”或“负”,下同)极相连:电解精炼铜时,粗铜应与电源_________ 极相连。
(2)利用如图1装置可模拟铁的电化学防护。

①为减缓铁的腐蚀,开关K应置于_________ (填“M”或“N”)处。
②若将石墨棒改为锌棒,开关K置于M处,该电化学防护法称为_________ 。
(3)用石墨电极电解100mL 和
和 的混合溶液,通电一段时间后,两极均收集到2.24L气体(标准状况下),原混合溶液中
的混合溶液,通电一段时间后,两极均收集到2.24L气体(标准状况下),原混合溶液中 的物质的量浓度为
的物质的量浓度为_________  。
。
(4)汽车尾气排放的CO、 等气体是大气污染的主要来源,
等气体是大气污染的主要来源, 也是雾霾天气的主要成因之一。利用反应
也是雾霾天气的主要成因之一。利用反应 消除
消除 的简易装置如图2所示。
的简易装置如图2所示。

①电极a的电极反应式为_________ 。
②常温下,若用该电池电解0.6L 1mol/L食盐水,当消耗336mL B气体(标准状况下)时,电解池中溶液的pH=_________ (假设电解过程溶液体积不变)。
(1)为防止铁器被腐蚀,常用电解法在其表面镀铜,此时铁器应与电源
(2)利用如图1装置可模拟铁的电化学防护。

①为减缓铁的腐蚀,开关K应置于
②若将石墨棒改为锌棒,开关K置于M处,该电化学防护法称为
(3)用石墨电极电解100mL
 和
和 的混合溶液,通电一段时间后,两极均收集到2.24L气体(标准状况下),原混合溶液中
的混合溶液,通电一段时间后,两极均收集到2.24L气体(标准状况下),原混合溶液中 的物质的量浓度为
的物质的量浓度为 。
。(4)汽车尾气排放的CO、
 等气体是大气污染的主要来源,
等气体是大气污染的主要来源, 也是雾霾天气的主要成因之一。利用反应
也是雾霾天气的主要成因之一。利用反应 消除
消除 的简易装置如图2所示。
的简易装置如图2所示。
①电极a的电极反应式为
②常温下,若用该电池电解0.6L 1mol/L食盐水,当消耗336mL B气体(标准状况下)时,电解池中溶液的pH=
您最近一年使用:0次
解题方法
6 .  溶液是一种重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用
溶液是一种重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用 溶液进行以下实验探究:
溶液进行以下实验探究:
(1)以 溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是___________ (填字母)。
a.溶液中 向阳极移动 b.粗铜接电源正极,发生还原反应
向阳极移动 b.粗铜接电源正极,发生还原反应
c.电解后 溶液的浓度减小 d.利用阳极泥可回收Ag、Pt、Au等金属
溶液的浓度减小 d.利用阳极泥可回收Ag、Pt、Au等金属
(2)图1是根据反应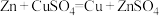 ,设计成的锌铜原电池。Cu极的电极反应式是
,设计成的锌铜原电池。Cu极的电极反应式是___________ ,盐桥中是含有琼胶的KCl饱和溶液,电池工作时 向
向___________ (填“甲”或“乙”)移动。

(3)图2中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜:
①b处通入的是___________ (填“ ”或“
”或“ ”),a处的电极反应式为
”),a处的电极反应式为___________ 。
②当铜电极的质量减轻3.2g,则消耗的 在标准状况下的体积为
在标准状况下的体积为___________ 。
 溶液是一种重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用
溶液是一种重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用 溶液进行以下实验探究:
溶液进行以下实验探究:(1)以
 溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是a.溶液中
 向阳极移动 b.粗铜接电源正极,发生还原反应
向阳极移动 b.粗铜接电源正极,发生还原反应c.电解后
 溶液的浓度减小 d.利用阳极泥可回收Ag、Pt、Au等金属
溶液的浓度减小 d.利用阳极泥可回收Ag、Pt、Au等金属(2)图1是根据反应
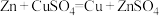 ,设计成的锌铜原电池。Cu极的电极反应式是
,设计成的锌铜原电池。Cu极的电极反应式是 向
向
(3)图2中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜:
①b处通入的是
 ”或“
”或“ ”),a处的电极反应式为
”),a处的电极反应式为②当铜电极的质量减轻3.2g,则消耗的
 在标准状况下的体积为
在标准状况下的体积为
您最近一年使用:0次
名校
解题方法
7 . 氟离子电池是一种前景广阔的新型电池,其能量密度是目前锂电池的十倍以上且不会因为过热而造成安全风险。如图是氟离子电池工作示意图,其中充电时 从乙电极流向甲电极。已知
从乙电极流向甲电极。已知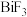 和
和 均难溶于水。下列说法正确的是
均难溶于水。下列说法正确的是

 从乙电极流向甲电极。已知
从乙电极流向甲电极。已知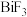 和
和 均难溶于水。下列说法正确的是
均难溶于水。下列说法正确的是
A.放电时,甲电极上的反应为: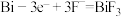 |
| B.放电时,乙电极电势比甲电极低 |
C.充电时,导线上每通过1mol ,甲电极质量增加38g ,甲电极质量增加38g |
| D.充电时,外加电源的正极与乙电极相连 |
您最近一年使用:0次
2022-12-28更新
|
711次组卷
|
3卷引用:陕西省渭南市华阴市2021-2022学年高二上学期期末考试化学试题
解题方法
8 . 某同学设计了如图所示装置,可探究氯碱工业原理和粗铜的精炼原理。

根据要求回答相关问题:
(1)甲装置中通入氧气的电极为_______ ,负极的电极反应式为_______ 。
(2)乙装置中Fe电极为_______ (填“阳极”或“阴极”),电极反应式为_______ 。
(3)乙中的X把电解槽隔成了阴极室和阳极室,X为_______ (填“阴”或“阳”)离子交换膜,它只允许溶液中的_______ 通过(填写下列微粒的编号),而两边的水不能自由流通。
①H2, ②Cl2 ,③H+, ④Cl- ,⑤Na+,⑥OH-。
(4)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间后, 溶液的浓度
溶液的浓度_______ (“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24L氧气参加反应,丙装置中阴极析出铜的质量为_______ g。

根据要求回答相关问题:
(1)甲装置中通入氧气的电极为
(2)乙装置中Fe电极为
(3)乙中的X把电解槽隔成了阴极室和阳极室,X为
①H2, ②Cl2 ,③H+, ④Cl- ,⑤Na+,⑥OH-。
(4)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间后,
 溶液的浓度
溶液的浓度(5)若在标准状况下,有2.24L氧气参加反应,丙装置中阴极析出铜的质量为
您最近一年使用:0次
名校
解题方法
9 . 传统接触法制取硫酸能耗大,污染严重。将燃料电池引入硫酸生产工艺可有效解决能耗和环境污染问题,同时提供电能。以燃料电池为电源电解硫酸铜溶液的工作原理示意图如下所示。下列说法不正确的是
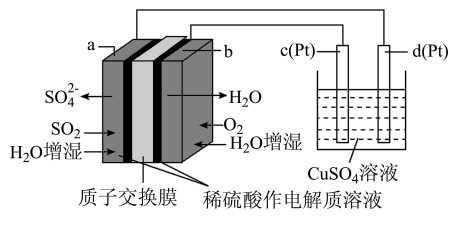

| A.b极为正极,电极反应式为O2+4H++4e-=2H2O |
| B.H+由a极通过质子交换膜向b极移动 |
| C.若a极消耗2.24 L(标准状况)SO2,理论上c极有6.4 g铜析出 |
| D.该燃料电池的总反应式为2SO2+O2+2H2O=2H2SO4 |
您最近一年使用:0次
2022-10-03更新
|
217次组卷
|
2卷引用:陕西省渭南高级中学2021-2022学年高一下学期第三阶段考试化学试题
解题方法
10 . 如图为阳离子交换膜法电解饱和食盐水的原理示意图。下列说法错误的是
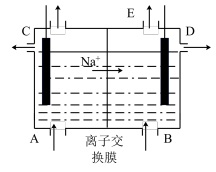

| A.左侧连接电源的负极 |
B.标准状况下,每生成 ,同时生成 ,同时生成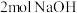 |
C.从E口逸出的气体是 |
| D.从A口加入精制饱和NaCl溶液 |
您最近一年使用:0次



