1 . 氧化还原反应可拆分为氧化和还原两个“半反应”。某小组同学从“半反应”的角度探究反应规律。
(1)已知:IO +I-→I2的转化在酸性条件下才能发生。
+I-→I2的转化在酸性条件下才能发生。
①该转化的还原半反应是2IO +10e-+12H+=I2+6H2O,则相应的氧化半反应是
+10e-+12H+=I2+6H2O,则相应的氧化半反应是_______ 。
②分析上述还原半反应可知:增大c(H+)可促进IO 得到电子,使其
得到电子,使其_______ 性增强,进而与I-发生反应
(2)探究Cu与浓盐酸能否发生反应。
①有同学认为Cu与浓盐酸不能发生反应产生氢气,其依据是_______ 。
用如下装置进行实验[硫酸与浓盐酸中c(H+)接近]。
②甲是对比实验,目的是排除_______ 的干扰。
③a.丙中气球变鼓是因为生成了_______ 气体(填化学式)。
b.经检测,丙中反应后溶液中存在[CuCl4]3-。从氧化还原性的角度分析丙中反应能够发生的原因:_______ 。
(3)探究以下原电池的工作原理。
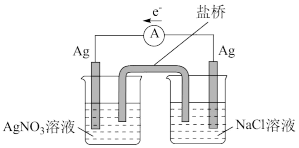
实验结果:产生电流,左侧Ag电极表面有Ag析出。右侧Ag电极周围生成AgCl。
①该装置中右侧Ag电极作_______ (填“正”或“负”)极。
②对该原电池的电极反应和总反应的反应类型进行分析,谈谈对原电池工作原理的认识:_______ 。
(1)已知:IO
 +I-→I2的转化在酸性条件下才能发生。
+I-→I2的转化在酸性条件下才能发生。①该转化的还原半反应是2IO
 +10e-+12H+=I2+6H2O,则相应的氧化半反应是
+10e-+12H+=I2+6H2O,则相应的氧化半反应是②分析上述还原半反应可知:增大c(H+)可促进IO
 得到电子,使其
得到电子,使其(2)探究Cu与浓盐酸能否发生反应。
①有同学认为Cu与浓盐酸不能发生反应产生氢气,其依据是
用如下装置进行实验[硫酸与浓盐酸中c(H+)接近]。
| 装置 | 序号 | 试管内药品 | 现象 |
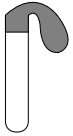 | 甲 | 浓盐酸 | 24小时后仍无明显变化 |
| 乙 | Cu粉+硫酸 | 24小时后仍无明显变化 | |
| 丙 | Cu粉+浓盐酸 | 24小时后气球变鼓 |
③a.丙中气球变鼓是因为生成了
b.经检测,丙中反应后溶液中存在[CuCl4]3-。从氧化还原性的角度分析丙中反应能够发生的原因:
(3)探究以下原电池的工作原理。

实验结果:产生电流,左侧Ag电极表面有Ag析出。右侧Ag电极周围生成AgCl。
①该装置中右侧Ag电极作
②对该原电池的电极反应和总反应的反应类型进行分析,谈谈对原电池工作原理的认识:
您最近一年使用:0次
23-24高一上·全国·假期作业
解题方法
2 . 将用导线连接的锌片和铜片插入盛有稀硫酸的烧杯中,下列叙述正确的是
| A.正极有O2逸出 | B.硫酸溶液的pH增大 |
| C.电子通过导线由铜片流向锌片 | D.锌片上有H2逸出 |
您最近一年使用:0次
2022-11-24更新
|
679次组卷
|
4卷引用:第08讲 化学反应与电能(讲义)-【寒假自学课】2023年高一化学寒假精品课(人教版2019必修第二册)
(已下线)第08讲 化学反应与电能(讲义)-【寒假自学课】2023年高一化学寒假精品课(人教版2019必修第二册)6.3.1化学能转化为电能(课中)-2019苏教版必修2课前课中课后吉林省辽源市田家炳高级中学校2023-2024学年高二上学期12月月考化学试题苏教2020版化学必修第二册专题6第三单元 化学能与电能的转化课后习题
3 . 某种电池充放电时的反应原理为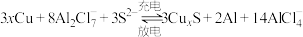 。下列物质为放电时负极产物的是
。下列物质为放电时负极产物的是
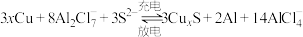 。下列物质为放电时负极产物的是
。下列物质为放电时负极产物的是A. | B. | C. | D.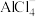 |
您最近一年使用:0次
2023-02-15更新
|
456次组卷
|
2卷引用:新疆生产建设兵团第二师八一中学2022-2023学年高一下学期期末考试化学试题
名校
4 . 现有X、Y、Z、W四种金属片,①把X、Y用导线连接后同时浸入硫酸溶液中,X上有气泡产生,Y溶解;②把Z、W用导线连接后同时浸入硫酸溶液中,W上发生还原反应;③把X、Z用导线连接后同时浸入硫酸溶液中,电子流动方向为X→导线→Z。则下列选项中正确的是
| A.①中金属片Y发生还原反应 |
| B.②中金属片W做负极 |
| C.上述四种金属的活动性顺序为Y>X>Z>W |
| D.如果把Y、W用导线相连后同时浸入硫酸溶液中,则电子流动方向为Y→导线→W |
您最近一年使用:0次
2021-04-28更新
|
757次组卷
|
3卷引用:山西省阳高县第一中学校2022-2023学年高一下学期期末考试化学试题
5 . 下列有关原电池的说法正确的是
| A.活泼的金属不一定作负极 | B.电池工作时,正极失去电子 |
| C.电池工作时,负极发生还原反应 | D.电解质溶液一定不能为浓硝酸 |
您最近一年使用:0次
解题方法
6 . 常见的铅蓄电池的电极材料为PbO2和Pb,电解液为30%的稀硫酸溶液,电池放电的总反应为PbO2+Pb+2H2SO4 2PbSO4+2H2O,则下列说法正确的是
2PbSO4+2H2O,则下列说法正确的是
 2PbSO4+2H2O,则下列说法正确的是
2PbSO4+2H2O,则下列说法正确的是| A.PbO2为电池的负极 | B.充电时电子由正极流向负极 |
| C.充电时阴极发生氧化反应 | D.放电时电解液的pH值逐渐增大 |
您最近一年使用:0次
2022-12-02更新
|
609次组卷
|
2卷引用:吉林省辽源市田家炳高级中学校2023-2024学年高二上学期12月月考化学试题
解题方法
7 . 将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在如图所示的情境中,下列有关说法正确的是
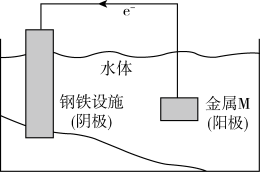

A.正极的电极反应式为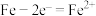 |
| B.金属M的活动性比Fe的活动性弱 |
| C.钢铁设施在河水中的腐蚀速率比在海水中的快 |
| D.当水体呈较强酸性时,钢铁设施表面会有气泡冒出 |
您最近一年使用:0次
2022-09-14更新
|
324次组卷
|
2卷引用:吉林省普通高中友好学校联合体2023-2024学年高二上学期期中联考化学试题
名校
8 . 化学电池的发明,是贮能和供能技术的巨大进步。
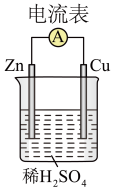
(1)如图所示装置中,Cu 片是_____ (填“正极”或“负极”)。
(2)写出负极发生的电极反应式_____ 。
(3)电子流动的方向是_____ 。
(4)如图所示装置可将_____ (写化学方程式)反应释放的能量 直接转变为电能;能证明产生电能的实验现象是_____ 。
(5)2019 年诺贝尔化学奖授予对锂离子电池研究做出突出贡献的科学家。某锂离子电池的工作原理如下。
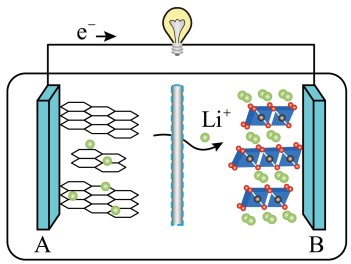
下列说法正确的是_____ (填序号)。
① A 为电池的正极
② 该装置实现了化学能转化为电能
③ 电池工作时,电池内部的锂离子定向移动

(1)如图所示装置中,Cu 片是
(2)写出负极发生的电极反应式
(3)电子流动的方向是
(4)如图所示装置可将
(5)2019 年诺贝尔化学奖授予对锂离子电池研究做出突出贡献的科学家。某锂离子电池的工作原理如下。

下列说法正确的是
① A 为电池的正极
② 该装置实现了化学能转化为电能
③ 电池工作时,电池内部的锂离子定向移动
您最近一年使用:0次
2020-05-02更新
|
1115次组卷
|
3卷引用:河北省衡水市武强中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
9 . LED(Light Emitting Diode),发光二极管,是一种能够将电能转化为可见光的固态的半导体器件,它可以直接把电能转化为光能。如图是课外活动小组设计的用化学电源使LED灯发光的装置。下列说法错误的是
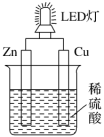

| A.Zn作负极,发生氧化反应 |
| B.电子流向:Zn→电解质溶液→Cu |
C.铜片上发生的反应为: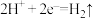 |
D.标准状况下,Zn片质量减小6.5g,Cu片上析出2.24L |
您最近一年使用:0次
2022-07-23更新
|
340次组卷
|
2卷引用:广东省广州科学城中学2022-2023学年高一下学期期中考试化学试题
名校
解题方法
10 . Ⅰ.在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用 表示。能量请认真观察下图,回答下列问题。
表示。能量请认真观察下图,回答下列问题。
(1)下列变化中满足如图图示的是___________ (填选项字母);
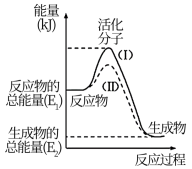
A.镁和稀盐酸的反应B.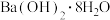 与
与 的反应
的反应
C.NaOH固体加入水中D.乙醇燃烧
Ⅱ.人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(2)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为___________ (填选项字母);
A.铝片、铜片B.铜片、铝片C.铝片、铝片
(3) 溶液常用于腐蚀印刷电路铜板,发生
溶液常用于腐蚀印刷电路铜板,发生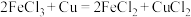 ,若将此反应设计成原电池,当线路中转移0.2mol电子时,则被腐蚀铜的质量为
,若将此反应设计成原电池,当线路中转移0.2mol电子时,则被腐蚀铜的质量为___________ g;
(4)燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:

①氢氧燃料电池的正极反应化学方程式是:___________ ,
②电池工作一段时间后硫酸溶液的pH___________ (填“增大”“减小”或“不变”)
(5)T℃时,在0.5L的密闭容器中,气体A与气体B反应生成气体C,反应过程中A、B、C的浓度变化如图所示。
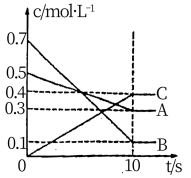
①该反应的化学方程式为___________ ,
②10s内用B表示的反应速率为___________ 。
 表示。能量请认真观察下图,回答下列问题。
表示。能量请认真观察下图,回答下列问题。(1)下列变化中满足如图图示的是

A.镁和稀盐酸的反应B.
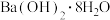 与
与 的反应
的反应C.NaOH固体加入水中D.乙醇燃烧
Ⅱ.人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(2)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为
A.铝片、铜片B.铜片、铝片C.铝片、铝片
(3)
 溶液常用于腐蚀印刷电路铜板,发生
溶液常用于腐蚀印刷电路铜板,发生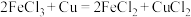 ,若将此反应设计成原电池,当线路中转移0.2mol电子时,则被腐蚀铜的质量为
,若将此反应设计成原电池,当线路中转移0.2mol电子时,则被腐蚀铜的质量为(4)燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:

①氢氧燃料电池的正极反应化学方程式是:
②电池工作一段时间后硫酸溶液的pH
(5)T℃时,在0.5L的密闭容器中,气体A与气体B反应生成气体C,反应过程中A、B、C的浓度变化如图所示。

①该反应的化学方程式为
②10s内用B表示的反应速率为
您最近一年使用:0次
2021-07-22更新
|
765次组卷
|
2卷引用:广东省汕尾市城区汕尾中学2022-2023学年高二下学期4月期中考试化学试题



