名校
解题方法
1 . “双碳(即碳达峰与碳中和)”要求加快降低碳排放步伐,引导绿色技术创新,提高产业和经济的全球竞争力。电催化 制备高附加值的化学品既能满足“双碳”要求,又能实现
制备高附加值的化学品既能满足“双碳”要求,又能实现 的资源化利用。回答下列问题:
的资源化利用。回答下列问题:
(1)杭州亚运会采用零碳甲醇点燃亚运主火炬,零碳甲醇是指采用 为原料制备的甲醇。利用质子交换膜进行废水处理,产生的
为原料制备的甲醇。利用质子交换膜进行废水处理,产生的 进行电催化合成甲醇的工作原理如图1、图2所示,这实现了废水处理的无废碳过程。
进行电催化合成甲醇的工作原理如图1、图2所示,这实现了废水处理的无废碳过程。
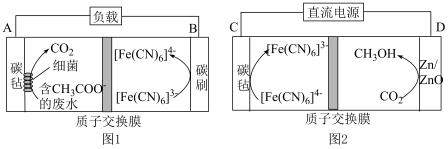
①图1中, 的移动方向是
的移动方向是___________ (填“向左移动”或“向右移动”)。
②图2中,生成甲醇的电极为___________ (填“阳极”或“阴极”),其电极反应式为___________ 。
③若图2中的“直流电源”用图1装置代替,则电极A连接___________ (填“C”或“D”)极。
(2)科技工作者设计了如图所示的电化学装置,该装置在室温下即能以 和甲醇为原料合成碳酸二甲酯(
和甲醇为原料合成碳酸二甲酯( )。
)。
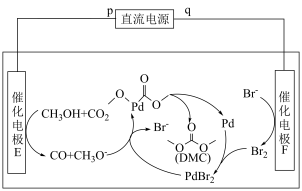
①直流电源的正极为___________ (填“p”或“q”)。
②电解总过程的化学方程式为___________ 。
③该电化学反应机理中,充当氧化剂的物质有___________ (填一种,填化学式或结构简式)。
(3)通过阴离子交换膜及合适的催化剂,先使 电催化转化为乙烯,乙烯再与氯碱电化学体系结合制备高附加值的环氧乙烷的工作原理如图所示:
电催化转化为乙烯,乙烯再与氯碱电化学体系结合制备高附加值的环氧乙烷的工作原理如图所示:
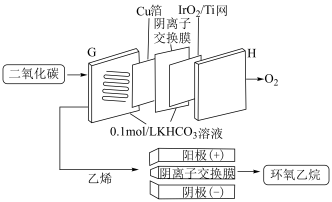
①环氧乙烷是氯碱电化学体系的___________ (填“阴”或“阳”)极产物。
②电极H上生成67.2L(标准状况) 时,理论上氯碱电化学体系可得到
时,理论上氯碱电化学体系可得到___________ g环氧乙烷。
 制备高附加值的化学品既能满足“双碳”要求,又能实现
制备高附加值的化学品既能满足“双碳”要求,又能实现 的资源化利用。回答下列问题:
的资源化利用。回答下列问题:(1)杭州亚运会采用零碳甲醇点燃亚运主火炬,零碳甲醇是指采用
 为原料制备的甲醇。利用质子交换膜进行废水处理,产生的
为原料制备的甲醇。利用质子交换膜进行废水处理,产生的 进行电催化合成甲醇的工作原理如图1、图2所示,这实现了废水处理的无废碳过程。
进行电催化合成甲醇的工作原理如图1、图2所示,这实现了废水处理的无废碳过程。
①图1中,
 的移动方向是
的移动方向是②图2中,生成甲醇的电极为
③若图2中的“直流电源”用图1装置代替,则电极A连接
(2)科技工作者设计了如图所示的电化学装置,该装置在室温下即能以
 和甲醇为原料合成碳酸二甲酯(
和甲醇为原料合成碳酸二甲酯( )。
)。
①直流电源的正极为
②电解总过程的化学方程式为
③该电化学反应机理中,充当氧化剂的物质有
(3)通过阴离子交换膜及合适的催化剂,先使
 电催化转化为乙烯,乙烯再与氯碱电化学体系结合制备高附加值的环氧乙烷的工作原理如图所示:
电催化转化为乙烯,乙烯再与氯碱电化学体系结合制备高附加值的环氧乙烷的工作原理如图所示:
①环氧乙烷是氯碱电化学体系的
②电极H上生成67.2L(标准状况)
 时,理论上氯碱电化学体系可得到
时,理论上氯碱电化学体系可得到
您最近一年使用:0次
2 . 20世纪初,德国化学家哈伯首次用锇作催化剂在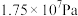 、550℃的条件下以
、550℃的条件下以 和
和 为原料合成了
为原料合成了 :
:
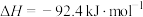 。2021年11月,我国报道了新的合成氨催化剂设计策略,该技术可实现温和条件下的氨催化合成。一种电化学气敏传感器可以检测生产中氨气的含量,其工作原理如图所示。下列说法正确的是
。2021年11月,我国报道了新的合成氨催化剂设计策略,该技术可实现温和条件下的氨催化合成。一种电化学气敏传感器可以检测生产中氨气的含量,其工作原理如图所示。下列说法正确的是
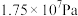 、550℃的条件下以
、550℃的条件下以 和
和 为原料合成了
为原料合成了 :
:
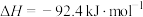 。2021年11月,我国报道了新的合成氨催化剂设计策略,该技术可实现温和条件下的氨催化合成。一种电化学气敏传感器可以检测生产中氨气的含量,其工作原理如图所示。下列说法正确的是
。2021年11月,我国报道了新的合成氨催化剂设计策略,该技术可实现温和条件下的氨催化合成。一种电化学气敏传感器可以检测生产中氨气的含量,其工作原理如图所示。下列说法正确的是
A.溶液中 向电极a移动 向电极a移动 |
B.电极a的电极反应式为 |
| C.在传感器工作一定时间后中电极b周围溶液pH减小 |
D.当电极b消耗标准状况下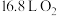 时,理论上电极a检测到 时,理论上电极a检测到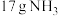 |
您最近一年使用:0次
2023-01-16更新
|
442次组卷
|
4卷引用:江苏省南通市2022-2023学年高二上学期1月期末考试化学试题
江苏省南通市2022-2023学年高二上学期1月期末考试化学试题(已下线)专题07 化学能与热能、电能-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(江苏专用)(已下线)题型03 新型化学电池-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)江苏省南通市海安市实验中学2023-2024学年高二上学期12月月考化学试题
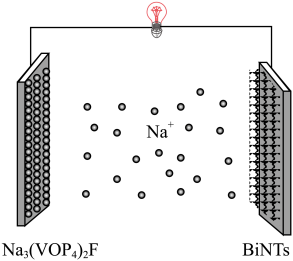
3 . 西南交通大学杨维清教授课题组成功合成空心铋纳米管(Bi NTs),化学反应原理为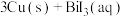
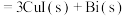 。以铋纳米管为负极设计了高能环保型钠离子电池。装置如图所示。已知:法拉第常数
。以铋纳米管为负极设计了高能环保型钠离子电池。装置如图所示。已知:法拉第常数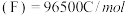 。V有+5价和+4价。下列叙述正确的是
。V有+5价和+4价。下列叙述正确的是
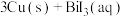
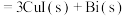 。以铋纳米管为负极设计了高能环保型钠离子电池。装置如图所示。已知:法拉第常数
。以铋纳米管为负极设计了高能环保型钠离子电池。装置如图所示。已知:法拉第常数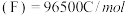 。V有+5价和+4价。下列叙述正确的是
。V有+5价和+4价。下列叙述正确的是
A.放电时,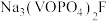 极区 极区 数增多 数增多 |
| B.放电时,Bi NTs极发生了还原反应 |
C.充电时,阳极反应为 |
| D.充电时,电流强度为5A,通电10min时阳极质量净增约0.12g |
您最近一年使用:0次
2023-01-03更新
|
201次组卷
|
2卷引用:湖南省长沙市长郡中学2022-2023学年高三上学期月考(四)化学试题
名校
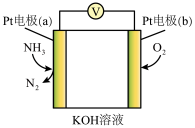
4 . 电化学的应用十分广泛,在分析检测、有机合成等领域应用很广,请分析下列几种电化学装置并回答问题:
Ⅰ.微生物燃料电池是废水处理中实现碳氮联合转化产生CO2和N2的装置,如图所示,1、2为厌氧微生物电极,3为阳离子交换膜,4为好氧微生物反应器。请回答:
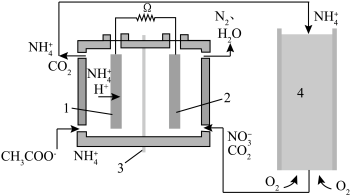
(1)电极2名称:___________ 极,电池工作一段时间后,电极2附近的pH___________ (填“增大”“减小”或“不变”)。
(2)在好氧微生物反应器中发生的反应方程式___________ 。
(3)若反应消耗O2(标准状况)4.48L,理论上生成N2物质的量为___________ mol。
II.次磷酸钴(II)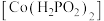 广泛用于化学镀钴,以金属钴和次磷酸钠为原料,采用四室电渗析槽电解法制备,原理如图。
广泛用于化学镀钴,以金属钴和次磷酸钠为原料,采用四室电渗析槽电解法制备,原理如图。
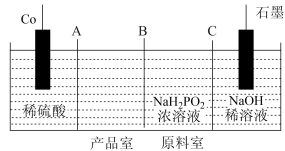
(4)A、B、C均为离子交换膜,其中为阳离子交换膜的是___________ 。
(5)石墨电极每生成1molH2时,___________ 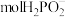 向
向___________ 迁移(填“阴极室”“阳极室”或“产品室”)。
(6)若以铅蓄电池为直流电源,则铅蓄电池中正极的电极反应式为___________ 。
(7)用 溶液化学镀钴是在强碱性条件下通过发生自身氧化还原反应,反应的同时会生成
溶液化学镀钴是在强碱性条件下通过发生自身氧化还原反应,反应的同时会生成 ,其离子方程式为
,其离子方程式为___________ 。
Ⅰ.微生物燃料电池是废水处理中实现碳氮联合转化产生CO2和N2的装置,如图所示,1、2为厌氧微生物电极,3为阳离子交换膜,4为好氧微生物反应器。请回答:

(1)电极2名称:
(2)在好氧微生物反应器中发生的反应方程式
(3)若反应消耗O2(标准状况)4.48L,理论上生成N2物质的量为
II.次磷酸钴(II)
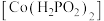 广泛用于化学镀钴,以金属钴和次磷酸钠为原料,采用四室电渗析槽电解法制备,原理如图。
广泛用于化学镀钴,以金属钴和次磷酸钠为原料,采用四室电渗析槽电解法制备,原理如图。
(4)A、B、C均为离子交换膜,其中为阳离子交换膜的是
(5)石墨电极每生成1molH2时,
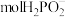 向
向(6)若以铅蓄电池为直流电源,则铅蓄电池中正极的电极反应式为
(7)用
 溶液化学镀钴是在强碱性条件下通过发生自身氧化还原反应,反应的同时会生成
溶液化学镀钴是在强碱性条件下通过发生自身氧化还原反应,反应的同时会生成 ,其离子方程式为
,其离子方程式为
您最近一年使用:0次
名校
5 . 氮化镓(GaN)与Cu可组成如下图所示的人工光合系统,该装置能以 和
和 为原料合成
为原料合成 。下列说法正确的是
。下列说法正确的是
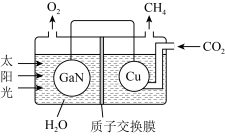
 和
和 为原料合成
为原料合成 。下列说法正确的是
。下列说法正确的是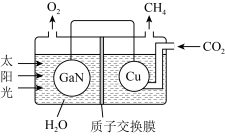
| A.Cu电极上发生氧化反应 |
B.溶液中 向Cu电极移动 向Cu电极移动 |
| C.该系统的功能是将化学能转化为电能 |
D.相同条件下,理论上产生的 和 和 气体的体积比为1:1 气体的体积比为1:1 |
您最近一年使用:0次
6 . 1905年哈珀开发实现了以氮气和氢气为原料合成氨气,生产的氨制造氮肥服务于农业,养活了地球三分之一的人口,哈珀也因此获得了1918年的诺贝尔化学奖。
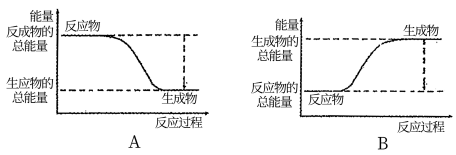
(1)工业合成氨的反应如下:N2+3H2 2NH3。已知断裂1 mol N2中的共价键吸收的能量为946 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2和H2生成1 mol NH3的能量变化为
2NH3。已知断裂1 mol N2中的共价键吸收的能量为946 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2和H2生成1 mol NH3的能量变化为________ kJ。下图能正确表示该反应中能量变化的是________ (填“A”或“B”)。
(2)反应2NH3(g) N2(g)+3H2(g)在三种不同条件下进行,N2、H2的起始浓度为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
N2(g)+3H2(g)在三种不同条件下进行,N2、H2的起始浓度为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
根据上述数据回答:对比实验①②中,有一个实验没有使用催化剂,它是实验_________ (填序号);实验①③对比说明了_________ 。在恒温恒容条件下,判断该反应达到化学平衡状态的标志是_________ (填序号)。
a.NH3的正反应速率等于逆反应速率 b.混合气体的密度不变
c.c(NH3)=c(H2) d.混合气体的压强不变
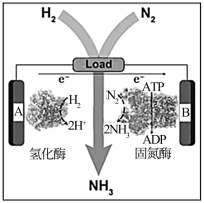
(3)近日美国犹他大学Minteer教授成功构筑了H2-N2生物燃料电池。该电池类似燃料电池原理,以氮气和氢气为原料、氢化酶和固氮酶为两极催化剂、质子交换膜(能够传递H+)为隔膜,在室温条件下即实现了氨的合成同时还能提供电能。则B电极为_________ 极(填“正”、“负”),该电池放电时溶液中的H+向_________ 极移动(填“A”、“B”)。
(1)工业合成氨的反应如下:N2+3H2
 2NH3。已知断裂1 mol N2中的共价键吸收的能量为946 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2和H2生成1 mol NH3的能量变化为
2NH3。已知断裂1 mol N2中的共价键吸收的能量为946 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2和H2生成1 mol NH3的能量变化为
(2)反应2NH3(g)
 N2(g)+3H2(g)在三种不同条件下进行,N2、H2的起始浓度为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
N2(g)+3H2(g)在三种不同条件下进行,N2、H2的起始浓度为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。实验 序号 | 时间 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
① | 400℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
② | 400℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
③ | 500℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据回答:对比实验①②中,有一个实验没有使用催化剂,它是实验
a.NH3的正反应速率等于逆反应速率 b.混合气体的密度不变
c.c(NH3)=c(H2) d.混合气体的压强不变
(3)近日美国犹他大学Minteer教授成功构筑了H2-N2生物燃料电池。该电池类似燃料电池原理,以氮气和氢气为原料、氢化酶和固氮酶为两极催化剂、质子交换膜(能够传递H+)为隔膜,在室温条件下即实现了氨的合成同时还能提供电能。则B电极为

您最近一年使用:0次



