23-24高三上·河北衡水·开学考试
名校
1 . 近年来甲醇用途日益广泛,越来越引起商家的关注。工业上甲醇的合成途径多种多样。现在实验室中模拟甲醇合成反应,在2 L密闭容器内,n(CO)和n(H2)按1:2 充入。在400 ℃时发生反应CO(g)+2H2(g) CH3OH(g),体系中n(CO)随时间的变化如表:
CH3OH(g),体系中n(CO)随时间的变化如表:
(1)图甲中表示CH3OH的变化的曲线是_______ (填序号)。
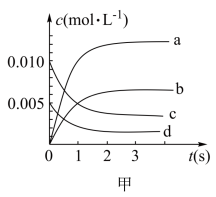
(2)此反应在前2s,H2 的反应速率是_______
(3)下列措施不能提高反应速率的有_______(填序号)。
(4)下列叙述能说明反应达到平衡状态的是_______ (填序号)。
a.CO和H2的浓度保持不变
b.v(H2)=2v(CO)
c.CO的物质的量分数保持不变
d.容器内气体密度保持不变
e.每生成1 mol CH3OH的同时有2 mol H-H键断裂
(5)CO(g)+2H2(g) CH3OH(g),此反应的平衡常数的表达式为:
CH3OH(g),此反应的平衡常数的表达式为:_____
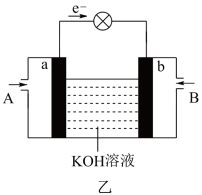
(6)CH3OH与O2的反应可将化学能转化为电能,其工作原理如图乙所示,图中CH3OH从_______ (填“A”或“B”)处通入。
 CH3OH(g),体系中n(CO)随时间的变化如表:
CH3OH(g),体系中n(CO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 5 |
| n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |

(2)此反应在前2s,H2 的反应速率是
(3)下列措施不能提高反应速率的有_______(填序号)。
| A.升高温度 |
| B.加入催化剂 |
| C.增大压强 |
| D.及时分离出CH3OH |
a.CO和H2的浓度保持不变
b.v(H2)=2v(CO)
c.CO的物质的量分数保持不变
d.容器内气体密度保持不变
e.每生成1 mol CH3OH的同时有2 mol H-H键断裂
(5)CO(g)+2H2(g)
 CH3OH(g),此反应的平衡常数的表达式为:
CH3OH(g),此反应的平衡常数的表达式为:(6)CH3OH与O2的反应可将化学能转化为电能,其工作原理如图乙所示,图中CH3OH从

您最近一年使用:0次
2 . 高纯硫酸锰在电池材料领域有重要用途。以软锰矿(主要成分为MnO2,含有少量铁和铝的氧化物)、硫铁矿(主要成分为FeS2)、钛白废酸(主要成分为H2SO4)为原料制备MnSO4·H2O的工艺流程如图:
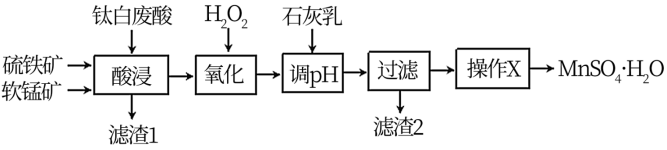
(1)“酸浸”时,为提高锰的浸出率,可采取的措施是___ ,“酸浸”过程中钛白废酸不宜过量太多,原因是___ 。
(2)在“酸浸”过程中,FeS2和MnO2颗粒组成两个原电池,如图所示,其中,MnO2原电池反应迅速,而FeS2原电池由于生成的硫覆盖在FeS2颗粒表面,溶解速率受阻变慢。
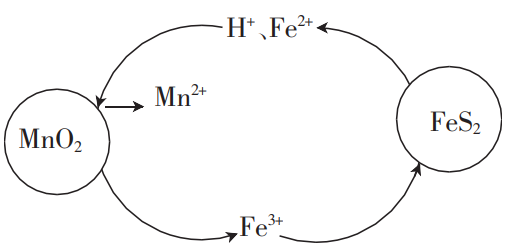
①MnO2原电池中,MnO2为原电池的___ (填“正极”或“负极”),每消耗1molMnO2,生成___ molFe3+。
②FeS2原电池负极上的电极反应式为___ 。
(3)已知部分金属阳离子开始沉淀和沉淀完全的pH如表:
①要除去Fe3+和Al3+,需要调节溶液的pH的范围为___ 。
②加入CaCO3也可以将滤液中的Fe3+转化为Fe(OH)3而除去,该反应的化学方程式为___ 。
③若石灰乳用量过大,则MnSO4·H2O的产量会___ (填“增加”、“减少”或“无影响”)。
(4)“操作X”为蒸发浓缩、___ 、过滤、洗涤、烘干。
(5)某工厂用10t软锰矿(含87%MnO2)制备MnSO4·H2O,最终得到MnSO4·H2O13.52t,则MnSO4·H2O的产率为___ 。

(1)“酸浸”时,为提高锰的浸出率,可采取的措施是
(2)在“酸浸”过程中,FeS2和MnO2颗粒组成两个原电池,如图所示,其中,MnO2原电池反应迅速,而FeS2原电池由于生成的硫覆盖在FeS2颗粒表面,溶解速率受阻变慢。

①MnO2原电池中,MnO2为原电池的
②FeS2原电池负极上的电极反应式为
(3)已知部分金属阳离子开始沉淀和沉淀完全的pH如表:
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.9 | 3.2 |
| Al3+ | 3.4 | 4.7 |
| Mn2+ | 8.1 | 10.1 |
| Fe2+ | 7 | 9.5 |
②加入CaCO3也可以将滤液中的Fe3+转化为Fe(OH)3而除去,该反应的化学方程式为
③若石灰乳用量过大,则MnSO4·H2O的产量会
(4)“操作X”为蒸发浓缩、
(5)某工厂用10t软锰矿(含87%MnO2)制备MnSO4·H2O,最终得到MnSO4·H2O13.52t,则MnSO4·H2O的产率为
您最近一年使用:0次
2021高三·全国·专题练习
3 . 高纯硫酸锰在电池材料领域有重要用途。以软锰矿(主要成分为MnO2,含有少量铁和铝的氧化物)、硫铁矿(主要成分为FeS2)、钛白废酸(主要成分为H2SO4)为原料制备MnSO4·H2O的工艺流程如图:

在“酸浸”过程中,FeS2和MnO2颗粒组成两个原电池,如图所示:
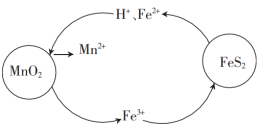
其中,MnO2原电池反应迅速,而FeS2原电池由于生成的硫覆盖在FeS2颗粒表面,溶解速率受阻变慢。
①MnO2原电池中,MnO2为原电池的___ (填“正极”或“负极”),每消耗1molMnO2,生成___ molFe3+。
②FeS2原电池负极上的电极反应式为___ 。

在“酸浸”过程中,FeS2和MnO2颗粒组成两个原电池,如图所示:

其中,MnO2原电池反应迅速,而FeS2原电池由于生成的硫覆盖在FeS2颗粒表面,溶解速率受阻变慢。
①MnO2原电池中,MnO2为原电池的
②FeS2原电池负极上的电极反应式为
您最近一年使用:0次



