名校
解题方法
1 . 电能是现代社会应用最广泛的能源之一、
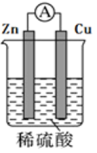
(1)某原电池装置如图所示。其中,Zn电极为原电池的___________ 极(填“正”或“负”)。
(2)Zn电极的电极反应式是___________ 。
(3)Cu电极上发生的反应属于___________ (填“氧化”或“还原”)反应。
(4)当铜表面析出4.48L氢气(标准状况)时,导线中通过了___________ mol电子。
(5)下列反应通过原电池装置,可实现化学能直接转化为电能的是___________ (填序号)。
①CaO+H2O=Ca(OH)2
②2H2+O2=2H2O
③2FeCl3+Cu=CuCl2+2FeCl2

(1)某原电池装置如图所示。其中,Zn电极为原电池的
(2)Zn电极的电极反应式是
(3)Cu电极上发生的反应属于
(4)当铜表面析出4.48L氢气(标准状况)时,导线中通过了
(5)下列反应通过原电池装置,可实现化学能直接转化为电能的是
①CaO+H2O=Ca(OH)2
②2H2+O2=2H2O
③2FeCl3+Cu=CuCl2+2FeCl2
您最近一年使用:0次
2021-05-07更新
|
1554次组卷
|
11卷引用:北京市西城区2018-2019学年高一第二学期期末考试化学试题
北京市西城区2018-2019学年高一第二学期期末考试化学试题北京市西城区高一化学下学期前三章综合阶段性试卷(已下线)考点09 电化学原理-2020年【衔接教材·暑假作业】新高三一轮复习化学辽宁省葫芦岛市2019-2020学年高一下学期期末考试化学试题吉林省通化县综合高级中学2020-2021学年高一下学期期中考试化学试题吉林省松原市乾安七中2020-2021学年高一下学期第七次质量检测化学试题安徽省亳州市第二中学2021-2022学年高二上学期开学摸底考试化学试题甘肃省兰州市教育局第四片区2021-2022学年高一下学期期中考试化学试题江西省南昌县莲塘第一中学2021-2022学年高一下学期4月期中线上质量检测化学试题云南省昆明光华学校2021-2022学年高一3月月考化学试题广西钦州市第四中学2021-2022学年高一下学期4月份考试化学试题
名校
解题方法
2 . (1)氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。
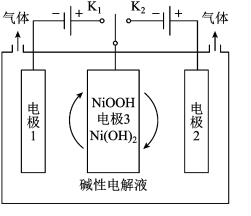
①制H2时,连接_____ 。产生H2的电极反应式是_____ 。
②改变开关连接方式,可得 O2。
③结合①和②中电极3的电极反应式,说明电极3的作用:_____ 。
(2)用零价铁(Fe)去除水体中的硝酸盐( )已成为环境修复研究的热点之一。
)已成为环境修复研究的热点之一。
①Fe 还原水体中 的反应原理如图所示。作负极的物质是
的反应原理如图所示。作负极的物质是_____ 。

正极的电极反应式是_____ 。
②将足量铁粉投入水体中,经 24 小时测定 的去除率和 pH,结果如下:
的去除率和 pH,结果如下:
pH=4.5 时, 的去除率低。其原因是
的去除率低。其原因是_____ 。

①制H2时,连接
②改变开关连接方式,可得 O2。
③结合①和②中电极3的电极反应式,说明电极3的作用:
(2)用零价铁(Fe)去除水体中的硝酸盐(
 )已成为环境修复研究的热点之一。
)已成为环境修复研究的热点之一。①Fe 还原水体中
 的反应原理如图所示。作负极的物质是
的反应原理如图所示。作负极的物质是
正极的电极反应式是
②将足量铁粉投入水体中,经 24 小时测定
 的去除率和 pH,结果如下:
的去除率和 pH,结果如下:| 初始 pH | pH=2.5 | pH=4.5 |
 的去除率3 的去除率3 | 接近100 % | <50 % |
| 24 小时 pH | 接近中性 | 接近中性 |
铁的最终物质形态 | FeO(OH)
| FeO(OH) |
 的去除率低。其原因是
的去除率低。其原因是
您最近一年使用:0次
解题方法
3 . 某兴趣小组为了探究铝电极在电池中的作用,设计并进行了以下系列实验,实验结果记录如下:
注:①实验均为常温下完成;②电流计指针偏转方向为正极方向。试根据表中实验现象完成下列问题:
(1)实验1、2中Al所作的电极(指正极或负极)______ (填“相同”或“不同”)。
(2)对实验3完成下列填空:
①Al为______ 极,电极反应式为______ 。
②石墨为______ 极,电极反应式为______ 。
③电池总反应式为______
(3)实验4中Al作______ 极,理由是______ 。
(4)解释实验5中电流计偏向Al的原因______ 。
(5)根据实验结果总结出影响铝在电池中作正极或负极的因素有______ 。
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | NaOH溶液 | 偏向Mg |
| 5 | Al、Cu | 浓硝酸 | 偏向Al |
注:①实验均为常温下完成;②电流计指针偏转方向为正极方向。试根据表中实验现象完成下列问题:
(1)实验1、2中Al所作的电极(指正极或负极)
(2)对实验3完成下列填空:
①Al为
②石墨为
③电池总反应式为
(3)实验4中Al作
(4)解释实验5中电流计偏向Al的原因
(5)根据实验结果总结出影响铝在电池中作正极或负极的因素有
您最近一年使用:0次
2020-08-21更新
|
396次组卷
|
3卷引用:北京市人大附中朝阳学校2019~2020年高一下学期阶段练习化学试题(选考班)
北京市人大附中朝阳学校2019~2020年高一下学期阶段练习化学试题(选考班)(已下线)第18讲 原电池 化学电源(练)-2023年高考化学一轮复习讲练测(全国通用)贵州省贵阳市白云区第二高级中学2021-2022学年高一下学期期中考试化学试题
名校
4 . Ⅰ.拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键需要吸收的能量分别为436 kJ、391 kJ、946 kJ。则1 mol N2生成NH3______ (填“吸收”或“放出”)_______ kJ热量;
Ⅱ.将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。已知,通入CH4的一极,其电极反应式是CH4-8e-+10OH-=CO +7H2O;通入O2的另一极,其电极反应式是2O2+8e-+4H2O=8OH-。请完成下列各题:
+7H2O;通入O2的另一极,其电极反应式是2O2+8e-+4H2O=8OH-。请完成下列各题:
(1)通入CH4的电极为________ 极,发生________ 反应。
(2)该燃料电池的总反应式为_________ 。
(3)若将该电池中的燃料改为氢气,请写出此时正、负极的反应式:正极_________ ,负极________ 。
Ⅱ.将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。已知,通入CH4的一极,其电极反应式是CH4-8e-+10OH-=CO
 +7H2O;通入O2的另一极,其电极反应式是2O2+8e-+4H2O=8OH-。请完成下列各题:
+7H2O;通入O2的另一极,其电极反应式是2O2+8e-+4H2O=8OH-。请完成下列各题:(1)通入CH4的电极为
(2)该燃料电池的总反应式为
(3)若将该电池中的燃料改为氢气,请写出此时正、负极的反应式:正极
您最近一年使用:0次
2020-08-06更新
|
335次组卷
|
3卷引用:山东省新泰市第一中学2019-2020高一下学期化学期末模拟二
5 . 现有反应:①NaOH+HCl=NaCl+H2O, ②Fe+H2SO4=FeSO4+H2↑。
回答下列问题:
(1)两反应中属于氧化还原反应的是_____ (填序号,下同),能设计成原电池的是___ 。
(2)Fe—Cu原电池的装置如图所示。
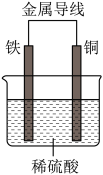
①铁作_____ (填“正极”或“负极”),溶液中H+向____ (填“铁”或“铜”)电极方向移动。
②正极的现象是________ ,负极的电极反应式为________ 。
回答下列问题:
(1)两反应中属于氧化还原反应的是
(2)Fe—Cu原电池的装置如图所示。

①铁作
②正极的现象是
您最近一年使用:0次
名校
解题方法
6 . 某小组同学在实验室中组装如下图所示装置,请回答:

(1)从能量转化的角度看,该装置是将____ (填能量转化的形式),符合该装置的化学反应类型一定是____ 反应。
(2)若 a 为锌片,b 为铜片,左右两侧烧杯中分别盛有ZnSO4溶液和CuSO4 溶液,则 b 极的电极反应式是_____ ,a 极可观察到的现象是______ ;导线中电子流动的 方向是_____ (用“a→b”或“b→a”表示),盐桥中的阳离子向______ (填“a”或“b”) 极方向移动。
(3)另一种原电池乙如下图所示装置,甲、乙两种原电池中可更有效地将化学能转化为电能的是______ (填“甲”或“乙”),其原因是_____ 。
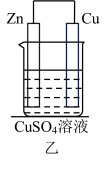

(1)从能量转化的角度看,该装置是将
(2)若 a 为锌片,b 为铜片,左右两侧烧杯中分别盛有ZnSO4溶液和CuSO4 溶液,则 b 极的电极反应式是
(3)另一种原电池乙如下图所示装置,甲、乙两种原电池中可更有效地将化学能转化为电能的是

您最近一年使用:0次
2020-07-04更新
|
306次组卷
|
3卷引用:北京市东城区北京景山学校2019-2020学年高二下学期期末考试化学试题
北京市东城区北京景山学校2019-2020学年高二下学期期末考试化学试题(已下线)第04章 电化学基础(B卷提升篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)重庆市缙云教育联盟2020-2021学年高二9月月考化学试题
解题方法
7 . 电能是现代社会应用最广泛的能源之一。
(1)如图所示装置中,Zn是_____ 极(填“正”或“负”)。
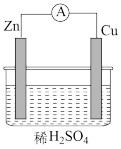
(2)如图所示装置可将______ (写化学方程式)反应释放的能量直接转变为电能;能证明产生电能的实验现象是_____ 。
(3)氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图所示。下列有关氢氧燃料电池的说法,正确的是______ 。

①电极b是正极
②外电路中电子由电极b通过导线流向电极a
③该电池的总反应:2H2+O2=2H2O
(1)如图所示装置中,Zn是

(2)如图所示装置可将
(3)氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图所示。下列有关氢氧燃料电池的说法,正确的是

①电极b是正极
②外电路中电子由电极b通过导线流向电极a
③该电池的总反应:2H2+O2=2H2O
您最近一年使用:0次
名校
解题方法
8 . 阅读短文,回答问题。
锂离子电池是一种生活中常见的二次电池,常用于手机、笔记本电脑、电动车中。它主要依靠Li+在正极材料(LixCOO2)和负极材料(石墨)之间往返嵌入和脱嵌来工作。低温时,由于电解液粘度增大,电池中锂离子的迁移能力下降。低温充电时石墨嵌锂速度降低,Li+来不及嵌入石墨中形成LixC,便得到电子被还原,容易在负极表面析出金属锂,降低电池容量,影响电池安全。上海复旦大学开发了一款新型锂离子电池,其放电的工作原理如图1所示。该电池不仅在-40℃下放电比容量没有衰降,甚至在-70℃下该电池的容量保持率也能够达到常温的70%左右,极大地拓展了电池的应用范围。复旦大学团队采用凝固点低、可在极端低温条件下导电的乙酸乙酯基电解液,并采用不需要将锂离子嵌入到电极中即可完成充、放电的有机物电极,避免了低温条件下嵌入过程变慢。请依据文章内容回答下列问题。

(1)判断下列说法是否正确_________ (填“对”或“错”)。
①新型锂离子电池有望在地球极寒地区使用。
②在传统锂离子电池中,金属锂是负极材料。
③若新型锂离子电池在常温下的放电比容量为99mAh·g-1,则其在-40℃下的放电比容量为99mAh·g-1。
(2)新型锂离子电池放电时,正极是_________ (填“A”或“B”)。
(3)下列关于该新型锂离子电池可耐低温原因的推测中,不正确的是_________ (填字母)。
a.采用与传统不同的有机物电极
b.乙酸乙酯基电解液的凝固点低
c.锂离子不需要在正负极间移动
锂离子电池是一种生活中常见的二次电池,常用于手机、笔记本电脑、电动车中。它主要依靠Li+在正极材料(LixCOO2)和负极材料(石墨)之间往返嵌入和脱嵌来工作。低温时,由于电解液粘度增大,电池中锂离子的迁移能力下降。低温充电时石墨嵌锂速度降低,Li+来不及嵌入石墨中形成LixC,便得到电子被还原,容易在负极表面析出金属锂,降低电池容量,影响电池安全。上海复旦大学开发了一款新型锂离子电池,其放电的工作原理如图1所示。该电池不仅在-40℃下放电比容量没有衰降,甚至在-70℃下该电池的容量保持率也能够达到常温的70%左右,极大地拓展了电池的应用范围。复旦大学团队采用凝固点低、可在极端低温条件下导电的乙酸乙酯基电解液,并采用不需要将锂离子嵌入到电极中即可完成充、放电的有机物电极,避免了低温条件下嵌入过程变慢。请依据文章内容回答下列问题。

(1)判断下列说法是否正确
①新型锂离子电池有望在地球极寒地区使用。
②在传统锂离子电池中,金属锂是负极材料。
③若新型锂离子电池在常温下的放电比容量为99mAh·g-1,则其在-40℃下的放电比容量为99mAh·g-1。
(2)新型锂离子电池放电时,正极是
(3)下列关于该新型锂离子电池可耐低温原因的推测中,不正确的是
a.采用与传统不同的有机物电极
b.乙酸乙酯基电解液的凝固点低
c.锂离子不需要在正负极间移动
您最近一年使用:0次
9 . 化学电源的发明是化学对人类的一项重大贡献。
(1)将锌片、铜片按照如图所示装置连接,铜片做__ 极(填“正”或“负”),外电路电子的流向为__ (填“Cu→Zn”或“Zn→Cu”)。
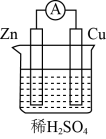
(2)若将装置中的稀H2SO4用CuSO4溶液替代,则相应原电池的总反应的化学方程式为__ 。
(3)下列化学反应通过原电池装置,可实现化学能直接转化为电能的是__ (填序号)。
①NaOH+HCl=NaCl+H2O
②CH4+2O2 CO2+2H2O
CO2+2H2O
③Fe+Cu2+=Cu+Fe2+
(1)将锌片、铜片按照如图所示装置连接,铜片做

(2)若将装置中的稀H2SO4用CuSO4溶液替代,则相应原电池的总反应的化学方程式为
(3)下列化学反应通过原电池装置,可实现化学能直接转化为电能的是
①NaOH+HCl=NaCl+H2O
②CH4+2O2
 CO2+2H2O
CO2+2H2O③Fe+Cu2+=Cu+Fe2+
您最近一年使用:0次
2020-06-02更新
|
457次组卷
|
6卷引用:北京市海淀区2018-2019学年高一学业水平合格性考试适应练习化学试题
名校
解题方法
10 . 电能是现代社会应用最广泛的能源之一。
(1)某原电池装置如图所示。其中,Zn 电极为原电池的______ 极(填“正” 或“负”),电极反应式是______ 。Cu 电极上发生的反应属于______ (填“氧化”或“还原”) 反应。
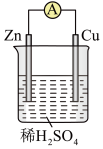
(2)能证明产生电能的实验现象是______ 。
(3)2019 年诺贝尔化学奖授予对锂离子电池研究做出突出贡献的科学家。某锂离子电池的工作原理如图。下列说法正确的是______ (填序号)。
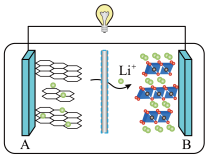
① A 为电池的正极
② 该装置实现了化学能转化为电能
③ 电池工作时,电池内部的锂离子定向移动
(1)某原电池装置如图所示。其中,Zn 电极为原电池的

(2)能证明产生电能的实验现象是
(3)2019 年诺贝尔化学奖授予对锂离子电池研究做出突出贡献的科学家。某锂离子电池的工作原理如图。下列说法正确的是

① A 为电池的正极
② 该装置实现了化学能转化为电能
③ 电池工作时,电池内部的锂离子定向移动
您最近一年使用:0次