名校
解题方法
1 . 现有反应①Ba(OH)2·8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑②Fe+H2SO4=FeSO4+H2↑。试回答下列问题:
(1)两反应中属于吸热反应的是___________ (填序号,下同),能设计成原电池的是___________ 。
(2)铁铜原电池的装置如图所示。
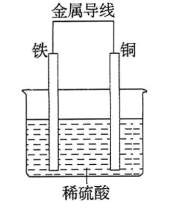
①铁作___________ (填“正极”或“负极”),溶液中的H+向___________ (填“铁”或“铜”)电极方向移动。
②正极的现象是___________ 。负极的电极方程式为___________ 。
③若反应过程中有0.2 mol电子的转移,则生成的氢气在标准状况下的体积为___________ L。
(1)两反应中属于吸热反应的是
(2)铁铜原电池的装置如图所示。

①铁作
②正极的现象是
③若反应过程中有0.2 mol电子的转移,则生成的氢气在标准状况下的体积为
您最近一年使用:0次
2021-10-08更新
|
736次组卷
|
7卷引用:河北省保定市2016-2017学年高一下学期期中考试化学试题
河北省保定市2016-2017学年高一下学期期中考试化学试题河南省开封市五县联考2020-2021学年高一下学期期中考试化学试题(已下线)6.1.2 化学反应与电能(练好题)(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)吉林省长春市2020-2021学年高一下学期期末联考化学试题广东省清远市2021-2022学年高一下学期期中调研考试化学试题甘肃省永昌县第一高级中学2021-2022学年高一下学期期中合格性考试化学试题(已下线)【期末复习】必刷题(2)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)
解题方法
2 . 微型纽扣电池在现代生活中应用广泛。有一种银锌电池,其电极分别是 和Zn,电解质溶液为KOH溶液,总反应式为
和Zn,电解质溶液为KOH溶液,总反应式为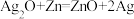 。回答下列问题:
。回答下列问题:
(1)Zn是_________ 极,发生_________ 反应,该电池的正极反应式为___________________________ 。
(2)电池内部电流方向是从_________ (填“ ”或“Zn”,下同)极流向
”或“Zn”,下同)极流向_________ 极,当外电路中有1mol 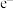 通过时,负极消耗的物质的质量是
通过时,负极消耗的物质的质量是_________ g。
(3)在使用过程中,电解质溶液中KOH的物质的量_________ (填“增大”“减小”或“不变”)。
 和Zn,电解质溶液为KOH溶液,总反应式为
和Zn,电解质溶液为KOH溶液,总反应式为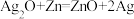 。回答下列问题:
。回答下列问题:(1)Zn是
(2)电池内部电流方向是从
 ”或“Zn”,下同)极流向
”或“Zn”,下同)极流向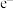 通过时,负极消耗的物质的质量是
通过时,负极消耗的物质的质量是(3)在使用过程中,电解质溶液中KOH的物质的量
您最近一年使用:0次
2020-12-30更新
|
153次组卷
|
3卷引用:河南省名校联盟2020-2021学年高二上学期12月联合考试化学试题
解题方法
3 . 目前,液流电池是电化学储能领域的一个研究热点,优点是储能容量大、使用寿命长。一种简单钒液流电池的电解液存储在储液罐中,放电时的结构及工作原理如图:
回答下列问题:
(1)放电时,导线中电流方向为_______ ,质子通过质子交换膜方向为_______ (填“从A到B”或“从B到A”)。
(2)用该电池作为电源电解饱和食盐水,电解反应的化学方程式为_______ ;若欲利用电解所得产物制取含149kgNaClO的消毒液用于环境消毒,理论上电解过程中至少需通过电路_____ mol电子。
(3)若将该电池电极连接电源充电,则A极连接电源的___ 极,发生的电极反应为______ 。

回答下列问题:
(1)放电时,导线中电流方向为
(2)用该电池作为电源电解饱和食盐水,电解反应的化学方程式为
(3)若将该电池电极连接电源充电,则A极连接电源的
您最近一年使用:0次
2020-12-06更新
|
250次组卷
|
3卷引用:山东省青岛市黄岛区2020-2021学年高二上学期期中考试化学试题
名校
解题方法
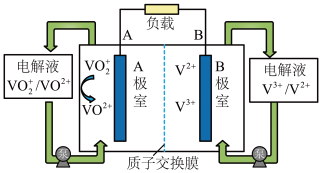
4 . 甲醇(CH3OH)—空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如下图:
(1)图中左侧电极为电源_______ 极,该电极的电极反应式为:__________ 。
(2)当电池消耗甲醇6.4g时,消耗的O2的体积为___________ L(标况下)。

(1)图中左侧电极为电源
(2)当电池消耗甲醇6.4g时,消耗的O2的体积为
您最近一年使用:0次
名校
解题方法
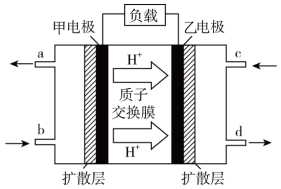
5 . 如图为原电池装置示意图。
(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是_____ (填字母)。
A.铝片、铜片B.铜片、铝片
C.铝片、铝片D.铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式_____ ;
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。写出B电极反应式_____ ,该电池在工作时,A电极的质量将___ (填“增加”“减小”或“不变”)。若该电池反应消耗了0.1molH2SO4,则转移电子的数目为_____ 。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入CH4和O2,该电池即为甲烷燃料电池,写出A电极反应式:_____ ;该电池在工作一段时间后,溶液的pH将_____ (填“增大”“减小”或“不变”)。

(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是
A.铝片、铜片B.铜片、铝片
C.铝片、铝片D.铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。写出B电极反应式
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入CH4和O2,该电池即为甲烷燃料电池,写出A电极反应式:
您最近一年使用:0次
2020-08-24更新
|
161次组卷
|
8卷引用:云南省玉溪市通海二中2018-2019学年高一5月份考试化学试题
解题方法
6 . 利用人工光合作用合成甲酸的原理为2CO2+2H2O 2HCOOH+O2,装置如图所示。
2HCOOH+O2,装置如图所示。
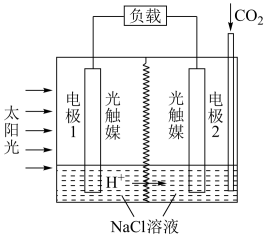
请回答下列问题:
(1)从能量角度分析,该装置将太阳能转化为___________ 。
(2)NaCl溶液的作用是___________ 。
(3)电极1为___________ (填“正极”或“负极”),电极2的电极反应式为___________ 。
(4)产生O2的电极是___________ (填“电极1”或“电极2”),每消耗0.5molCO2时,理论上生成O2体积为___________ (标准状况下)。
 2HCOOH+O2,装置如图所示。
2HCOOH+O2,装置如图所示。
请回答下列问题:
(1)从能量角度分析,该装置将太阳能转化为
(2)NaCl溶液的作用是
(3)电极1为
(4)产生O2的电极是
您最近一年使用:0次
名校
解题方法
7 . 燃料电池是一种新能源。利用2CO+O2═2CO2设计燃料电池时,负极发生反应的气体是__ ,正极发生反应的气体是__ 。
您最近一年使用:0次
2020-06-29更新
|
101次组卷
|
3卷引用:河南省许昌市长葛市第一高级中学2019-2020学年高二月考化学试题
解题方法
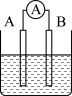
8 . 在铜、锌、稀硫酸构成的原电池中(如图所示)
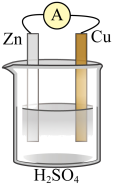
(1)负极是__________ (填“铜”或“锌”),_________ 电子(填“失去”或“得到”),发__________ (填“氧化”或 “还原”),电极反应方程式______________ ;
(2)电流由__________ 流向__________ (填“铜”或“锌),铜片上观察到的现象是________________ 。

(1)负极是
(2)电流由
您最近一年使用:0次
2019-11-28更新
|
232次组卷
|
3卷引用:河南省新乡市辉县市第二高级中学2019-2020学年高一下学期期中考试化学试题
名校
解题方法
9 . (1)高铁酸钾( K2FeO4)不仅是一种理想的水处理剂(胶体),而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:
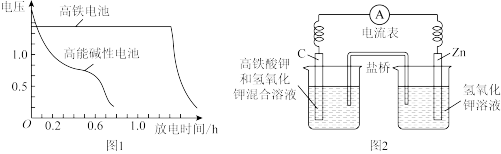
①该电池放电时正极的电极反应式为____________________________________ ;
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向________ (填“左”或“右”)移动;若用阳离子交换膜代替盐桥,则钾离子向______ (填“左”或“右”)移动。
③图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有_____________________________________________________________ 。
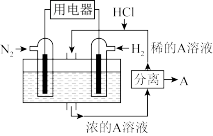
(2)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是____________________ ,A是____________ 。
(3)利用原电池工作原理测定汽车尾气中CO的浓度,其装置如图所示。该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向________ (填“从a到b”或“从b到a”),负极发生的电极反应式为___________________ 。
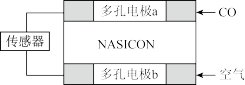

①该电池放电时正极的电极反应式为
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向
③图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有
(2)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是

(3)利用原电池工作原理测定汽车尾气中CO的浓度,其装置如图所示。该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向
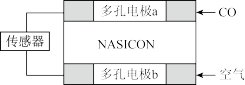
您最近一年使用:0次
2019-11-28更新
|
275次组卷
|
5卷引用:福建省莆田四中2019-2020学年高二上学期期中考试化学试题
福建省莆田四中2019-2020学年高二上学期期中考试化学试题河南省焦作市博爱县第一中学2023-2024学年高三上学期10月月考化学试题福建省莆田市第二中学2021-2022学年高二上学期10月阶段检测化学试题(已下线)专题六 化学反应与能量 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第3讲 原电池 化学电源
10 . 正确认识和使用电池有利于我们每一个人的日常生活。
I.电化学法处理SO2是目前研究的热点。利用双氧水氧化吸收SO2可消除SO2污染,设计装置如图所示(已知石墨只起导电作用,质子交换膜只允许H+通过)。
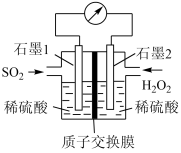
(1)石墨1为____ (填“正极”或“负极”),正极的电极反应式为______ 。
(2)反应的总方程式为_______ 。
(3)H+的迁移方向为由_____ 到____ 。(填“左”或“右”)
(4)若11.2L(标准状况)SO2参与反应,则迁移H+的物质的量为____ 。
(5)某同学关于原电池的笔记中,不合理的有____ 。
①原电池两电极材料活泼性一定不同
②原电池负极材料参与反应,正极材料都不参与反应
③Fe-NaOH溶液-Si原电池,Fe是负极
④原电池是将化学能转变为电能的装置
Ⅱ.航天技术中使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。氢氧燃料电池有多种。
(1)某碱式氢氧燃料电池的电解质溶液是KOH溶液,则其负极反应为_____ ;某熔盐氢氧燃料电池的电解质是熔融的碳酸钾,则其负极反应为_____ 。
(2)氢氧燃料电池用于航天飞船,电极反应产生的水,经过冷凝后可用作航天员的饮用水,当得到1.8g饮用水时,转移的电子数约为_____ 。
I.电化学法处理SO2是目前研究的热点。利用双氧水氧化吸收SO2可消除SO2污染,设计装置如图所示(已知石墨只起导电作用,质子交换膜只允许H+通过)。

(1)石墨1为
(2)反应的总方程式为
(3)H+的迁移方向为由
(4)若11.2L(标准状况)SO2参与反应,则迁移H+的物质的量为
(5)某同学关于原电池的笔记中,不合理的有
①原电池两电极材料活泼性一定不同
②原电池负极材料参与反应,正极材料都不参与反应
③Fe-NaOH溶液-Si原电池,Fe是负极
④原电池是将化学能转变为电能的装置
Ⅱ.航天技术中使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。氢氧燃料电池有多种。
(1)某碱式氢氧燃料电池的电解质溶液是KOH溶液,则其负极反应为
(2)氢氧燃料电池用于航天飞船,电极反应产生的水,经过冷凝后可用作航天员的饮用水,当得到1.8g饮用水时,转移的电子数约为
您最近一年使用:0次
2019-04-26更新
|
458次组卷
|
2卷引用:【全国百强校】河南省郑州市第一中学2018-2019学年高一下学期期中考试化学试题



