名校
1 . 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、100g16.0%的CuSO4溶液和100g10.00%的K2SO4溶液,电极均为石墨电极。接通电源,经过一段时间后,测得丙中K2SO4的质量分数为12.20%,乙中c电极质量增加。据此回答问题:

(1)电源的N端为___________ 极。
(2)电极b上发生的电极反应式为___________
(3)电极b上生成的气体在标准状况下的体积。___________ 。

(1)电源的N端为
(2)电极b上发生的电极反应式为
(3)电极b上生成的气体在标准状况下的体积。
您最近一年使用:0次
解题方法
2 . 已知可逆反应: 。设计如图所示装置(盐桥中的阴、阳离子可以自由移动,盐桥在原电池中不参与反应,只起导电作用)。
。设计如图所示装置(盐桥中的阴、阳离子可以自由移动,盐桥在原电池中不参与反应,只起导电作用)。
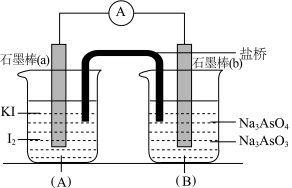
进行如下操作:
(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,发现电流表指针偏转;
(Ⅱ)若改往(B)烧杯中滴加质量分数为40%的NaOH溶液,发现电流表指针向相反方向偏转。
(1)两次操作过程中电流表指针偏转方向为什么会相反?
试用电极反应和化学平衡移动的原理解释此现象:____________________________________ 。
(2)(Ⅰ)操作过程中石墨棒(a)上发生的电极反应为____________________________________ 。
(3)(Ⅱ)操作过程中石墨棒(b)上发生的电极反应为____________________________________ 。
 。设计如图所示装置(盐桥中的阴、阳离子可以自由移动,盐桥在原电池中不参与反应,只起导电作用)。
。设计如图所示装置(盐桥中的阴、阳离子可以自由移动,盐桥在原电池中不参与反应,只起导电作用)。
进行如下操作:
(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,发现电流表指针偏转;
(Ⅱ)若改往(B)烧杯中滴加质量分数为40%的NaOH溶液,发现电流表指针向相反方向偏转。
(1)两次操作过程中电流表指针偏转方向为什么会相反?
试用电极反应和化学平衡移动的原理解释此现象:
(2)(Ⅰ)操作过程中石墨棒(a)上发生的电极反应为
(3)(Ⅱ)操作过程中石墨棒(b)上发生的电极反应为
您最近一年使用:0次
解题方法
3 . 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。
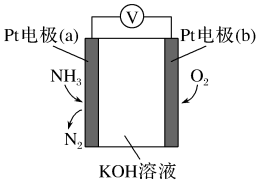
(1)Pt电极(a)为_______ 极(填“正”或“负”);
(2)Pt电极(b)上发生的反应为_______ (填“氧化”或“还原”)反应。
(3)该过程总反应的化学反应方程式为_______ 。

(1)Pt电极(a)为
(2)Pt电极(b)上发生的反应为
(3)该过程总反应的化学反应方程式为
您最近一年使用:0次
解题方法
4 . 下图是利用一种微生物将废水中尿素(H2NCONH2)的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁器上镀铜。
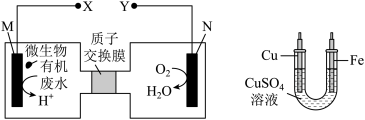
(1)M是电池的__ 极。N的电极反应式是_______ 。
(2)若废水中尿素的质量分数为0.06%,处理1 t该废水,假设尿素完全转化,被电镀的铁器增重_____ g。

(1)M是电池的
(2)若废水中尿素的质量分数为0.06%,处理1 t该废水,假设尿素完全转化,被电镀的铁器增重
您最近一年使用:0次
解题方法
5 . CO是一种重要的能源物质。
(1)下列反应原理适合实验室制备CO的是_______ (填选项字母)。
A.C+H2O CO+H2B.2C+O2
CO+H2B.2C+O2 2CO C.HCOOH
2CO C.HCOOH CO+H2O
CO+H2O
(2)用于检测CO含量的某气敏传感器的工作原理如图所示。

①该装置工作时,将_______ 能转化为______ 能。
②工作时,电极 I 作____ 极,电极 II 上的电极反应式为_____________ 。
③向电极 I 缓缓通入10 L 混合气体 ( 其他气体不参加反应)后,测得电路中通过2 mole-,则该混合气体中CO的含量为___ mol/L
(1)下列反应原理适合实验室制备CO的是
A.C+H2O
 CO+H2B.2C+O2
CO+H2B.2C+O2 2CO C.HCOOH
2CO C.HCOOH CO+H2O
CO+H2O(2)用于检测CO含量的某气敏传感器的工作原理如图所示。

①该装置工作时,将
②工作时,电极 I 作
③向电极 I 缓缓通入10 L 混合气体 ( 其他气体不参加反应)后,测得电路中通过2 mole-,则该混合气体中CO的含量为
您最近一年使用:0次
名校
解题方法
6 . 据报导,我国已研制出“可充室温钠-二氧化碳电池”。该电池的总反应式为4Na+3CO2 2Na2CO3+C,其工作原理如图所示(放电时产生的Na2CO3固体贮存于碳纳米管中)。
2Na2CO3+C,其工作原理如图所示(放电时产生的Na2CO3固体贮存于碳纳米管中)。
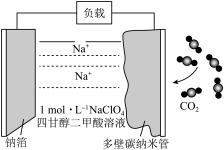
(1)放电时,钠箔为该电池的_____ 极(填“正”或“负”);电解质溶液中 流向
流向_____ (填“钠箔”或“多壁碳纳米管”)电极。
(2)放电时每消耗3 mol CO2,转移电子数为______ 。
(3)充电时,碳纳米管连接直流电源的______ (填“正”或“负”)极,其电极反应式为_______ 。
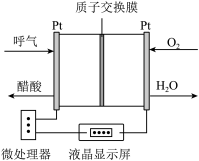
(4)负载可以测定电流大小,从而确定气体含量,酒驾测定工作原理与其相似(如图所示),写出测定酒驾时负极的电极反应式:________ 。
 2Na2CO3+C,其工作原理如图所示(放电时产生的Na2CO3固体贮存于碳纳米管中)。
2Na2CO3+C,其工作原理如图所示(放电时产生的Na2CO3固体贮存于碳纳米管中)。
(1)放电时,钠箔为该电池的
 流向
流向(2)放电时每消耗3 mol CO2,转移电子数为
(3)充电时,碳纳米管连接直流电源的
(4)负载可以测定电流大小,从而确定气体含量,酒驾测定工作原理与其相似(如图所示),写出测定酒驾时负极的电极反应式:

您最近一年使用:0次
2020-08-04更新
|
248次组卷
|
3卷引用:江苏省徐州市2019-2020学年高二下学期期中抽测化学试题
江苏省徐州市2019-2020学年高二下学期期中抽测化学试题(已下线)第04章 电化学基础(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)河北省保定市唐县第一中学2022-2023学年高二上学期10月期中考试化学试题
名校
7 . 利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,回答问题:


(1)电流从____ (选填“左”或“右”,下同)侧电极经过负载后流向______ 侧电极。
(2)为使电池持续放电,离子交换膜需选用______ 离子交换膜(选填“阴”或“阳”)。
(3)A电极上的电极反应式为___________________________ 。
(4)当有4.48 L NO2(标准状况)被处理时,转移电子为________ 摩尔。
(5)负载可以测定电流大小,从而确定气体含量,酒驾测定工作原理与其相似。仔细阅读图:写出阴极反应式:____________________________ 。


(1)电流从
(2)为使电池持续放电,离子交换膜需选用
(3)A电极上的电极反应式为
(4)当有4.48 L NO2(标准状况)被处理时,转移电子为
(5)负载可以测定电流大小,从而确定气体含量,酒驾测定工作原理与其相似。仔细阅读图:写出阴极反应式:
您最近一年使用:0次
名校
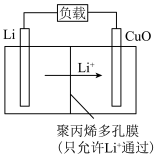
8 . Li—CuO二次电池的比能量高、工作温度宽,性能优异,广泛应用于军事和空间领域。
(1)Li—CuO电池中,金属锂做_______ 极 。
(2)比能量是指消耗单位质量的电极所释放的电量,用来衡量电池的优劣。比较Li、Na、Al分别作为电极时比能量的大小:____________ 。
(3)通过如下过程制备CuO。

①过程Ⅰ,H2O2的作用是__________________ 。
②过程Ⅱ产生Cu2(OH)2CO3的离子方程式是_____________________ 。
③过程Ⅱ,将CuSO4溶液加到Na2CO3溶液中,研究二者不同物质的量之比与产品纯度的关系(用测定铜元素的百分含量来表征产品的纯度),结果如下:
已知:Cu2(OH)2CO3中铜元素的百分含量为57.7%。
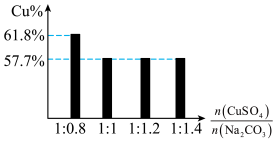
二者比值为1:0.8时,产品中可能含有的杂质是_____________ ,产生该杂质的原因是_________________________________ 。
④ 过程Ⅲ反应的化学方程式是_________________________ 。
(4)Li—CuO二次电池以含Li+的有机溶液为电解质溶液,其工作原理示意如下。放电时,正极的电极反应式是______________________ 。
(1)Li—CuO电池中,金属锂做
(2)比能量是指消耗单位质量的电极所释放的电量,用来衡量电池的优劣。比较Li、Na、Al分别作为电极时比能量的大小:
(3)通过如下过程制备CuO。

①过程Ⅰ,H2O2的作用是
②过程Ⅱ产生Cu2(OH)2CO3的离子方程式是
③过程Ⅱ,将CuSO4溶液加到Na2CO3溶液中,研究二者不同物质的量之比与产品纯度的关系(用测定铜元素的百分含量来表征产品的纯度),结果如下:
已知:Cu2(OH)2CO3中铜元素的百分含量为57.7%。

二者比值为1:0.8时,产品中可能含有的杂质是
④ 过程Ⅲ反应的化学方程式是
(4)Li—CuO二次电池以含Li+的有机溶液为电解质溶液,其工作原理示意如下。放电时,正极的电极反应式是

您最近一年使用:0次
2017-10-25更新
|
522次组卷
|
4卷引用:山东省济南外国语学校2018届高三上学期阶段考试化学试题
山东省济南外国语学校2018届高三上学期阶段考试化学试题【市级联考】北京市2019届高三上学期一轮复习理科综合能力测试化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题09-2020年北京新高考化学模拟试题(已下线)寒假作业08 原电池-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)
10-11高二下·浙江杭州·期中
9 . 从某铝镁合金片上剪下一小块(质量为1.0g),立即投入到盛有10mL10mol/LNaOH溶液的小烧杯中。
(1)自反应开始到反应结束,从小烧杯中可观察到的主要现象。(请依次写出)
(2)开始时产生气泡的速率较慢的原因是________________________________ 。后来的反应速率相当快的原因是___________________________________ 。
(3)写出所形成的原电池的负极材料名称:________________________________
电极反应式:____________________________________
(4)欲利用该反应来测定合金中铝的含量,还应测定的数据:_______________________ (请逐一写出)
(1)自反应开始到反应结束,从小烧杯中可观察到的主要现象。(请依次写出)
(2)开始时产生气泡的速率较慢的原因是
(3)写出所形成的原电池的负极材料名称:
电极反应式:
(4)欲利用该反应来测定合金中铝的含量,还应测定的数据:
您最近一年使用:0次



