名校
1 . 化学电源广泛地应用于现代社会的生产和生活。请回答下列问题:
(1)原电池的设计原理与某类化学反应有关。你认为下列化学反应,可以设计成原电池的是_______(填字母)。
(2)化学反应均涉及相应的能量变化,为探究这些能量变化,某同学设计了如图实验。

①该实验过程涉及的能量变化是_______ 。
②Zn棒是_______ 极,电流方向是从_______ 棒流向_______ 棒。
(3)若将两个金属棒用导线相连在一起,总质量为80.00 g的锌片和银片同时浸入稀硫酸中,工作一段时间后,取出金属片,进行洗涤、干燥、称量,得金属片的总质量为63.75 g,则装置工作时锌片上的电极反应式为_______ ,工作时间内装置所产生氢气的体积为_______ L(标准状况)。
(4)回答下列问题:

①该燃料电池中正极通入的物质是_______ ,负极发生的反应式为_______ 。
②电池工作时,OH-移向_______ 电极(填“a”或“b”)。
③当电池放电转移10 mol电子时,至少消耗燃料肼_______ g。
(1)原电池的设计原理与某类化学反应有关。你认为下列化学反应,可以设计成原电池的是_______(填字母)。
| A.CaO+H2O=Ca(OH)2 | B.C+CO2 2CO 2CO |
| C.NaOH+HCl=NaCl+H2O | D.2FeCl3+Cu=2FeCl2+CuCl2 |

①该实验过程涉及的能量变化是
②Zn棒是
(3)若将两个金属棒用导线相连在一起,总质量为80.00 g的锌片和银片同时浸入稀硫酸中,工作一段时间后,取出金属片,进行洗涤、干燥、称量,得金属片的总质量为63.75 g,则装置工作时锌片上的电极反应式为
(4)回答下列问题:

①该燃料电池中正极通入的物质是
②电池工作时,OH-移向
③当电池放电转移10 mol电子时,至少消耗燃料肼
您最近一年使用:0次
22-23高一下·广东深圳·期中
名校
2 . 微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是
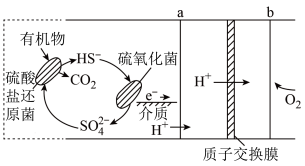

| A.该电池在高温条件下效率更高 |
B.电子从 流出,经外电路流向 流出,经外电路流向 |
C. 在硫氧化菌作用下转化为 在硫氧化菌作用下转化为 的反应是 的反应是 |
D.若该电池电路中有 电子发生转移,则参与反应 电子发生转移,则参与反应 的物质的量为 的物质的量为 |
您最近一年使用:0次
名校
解题方法
3 . 一种向外输出电能的同时,又能使水土中重金属离子Cd2+变成沉淀而被除去的电化学装置,其工作原理如图所示,下列说法正确的是
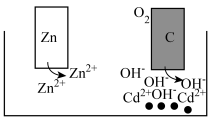

| A.锌棒为该装置的正极 |
| B.电子从锌棒经水土移向碳棒 |
| C.碳棒附近Cd2+转化为Cd而被除去 |
| D.标准状况下,每消耗22.4 LO2,理论上最多能除去2 mol Cd2+ |
您最近一年使用:0次
2023-09-08更新
|
326次组卷
|
3卷引用:广东省广州市第六中学2024届高中毕业班第一次调研考试化学试题
名校
解题方法
4 . 燃料电池是一种将燃料和氧化剂的化学能直接转化为电能的电化学反应装置,下图为甲醇燃料电池的简易装置。下列说法正确的是
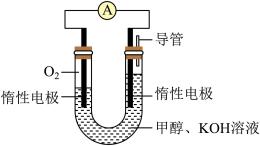
| A.左侧电极为负极,发生氧化反应 |
| B.OH-移向右侧电极,故左侧电极附近溶液碱性变弱 |
C.右侧电极的电极反应式: |
| D.此电池生成3 mol H2O时,转移电子数为6NA |
您最近一年使用:0次
2023-07-13更新
|
314次组卷
|
3卷引用:广东省东莞市东华高级中学2023-2024学年高二上学期开学考试化学试题
解题方法
5 . 镍镉电池是二次电池,其工作原理如图(L为小灯泡,K1、K2为开关,a、b为直流电源两极)。下列说法不正确的是
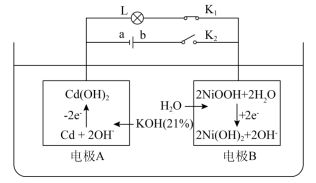

| A.断开K2、合上K1,OH-从电极B移向电极A |
| B.电极B发生还原反应过程中,溶液中的KOH浓度没有变化 |
| C.断开K1、合上K2,电极A为阴极,发生还原反应 |
D.镍镉二次电池的总反应式: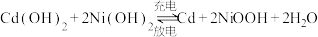 |
您最近一年使用:0次
2022-11-22更新
|
518次组卷
|
3卷引用:广东省广州市三校(广附,铁一,广外)2022-2023学年高二上学期期末联考化学试题
广东省广州市三校(广附,铁一,广外)2022-2023学年高二上学期期末联考化学试题(已下线)【知识图鉴】单元讲练测选择性必修1第4单元03巩固练福建省三明市五校协作2022-2023学年高二上学期期中联考化学试题
9-10高一下·辽宁沈阳·期末
名校
解题方法
6 . 如图,在盛有稀 的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是
的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是

 的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是
的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是
A.外电路的电流方向为 外电路 外电路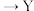 |
| B.若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe |
| C.X极上发生的是还原反应,Y极上发生的是氧化反应 |
D.若两电极都是金属,则它们的活动性顺序为 |
您最近一年使用:0次
2023-06-09更新
|
745次组卷
|
60卷引用:广东省开平市忠源纪念中学2022-2023学年高一下学期4月期中考试化学试题
广东省开平市忠源纪念中学2022-2023学年高一下学期4月期中考试化学试题广东省珠海市第二中学2020-2021学年高一下学期期中考试化学试题5.3.2 化学变化中的能量变化(第2课时)-【帮课堂】高一化学同步精品讲义(沪科版2020必修第二册)广东省湛江市雷州市白沙中学2021-2022学年高一下学期第一次月考化学试题湖南省邵阳市新邵县2022-2023学年高一下学期期末考试化学试题(已下线)考点18 原电池 化学电源(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第3讲 原电池 化学电源江西省丰城市东煌学校2022-2023学年高一下学期6月期末考试化学试题(已下线)09-10年度沈阳市重点高中高一下学期联考化学卷(已下线)2010年温州市省一级重点中学高一下学期期末统一测试化学试题2014-2015学年四川省成都市树德中学高一下学期期末考试化学试卷2016届福建省莆田市第二十五中学高三上学期期中测试化学试卷2015-2016学年甘肃天水一中高一下第一次月考化学试卷2015-2016学年新疆兵团农二师华山中学高二下第一次月考化学试卷 2016-2017学年辽宁省葫芦岛市六校协作体高二上期初考试化学卷2016-2017学年西藏拉萨北京实验中学高二上期末化学卷云南省中央民族大学附属中学芒市国际学校2016-2017学年高一下学期期末考试化学试题河南省郑州市第一中学2017-2018学年高二上学期期中考试化学试题河北省故城县高级中学2017-2018学年高一3月月考化学试题【全国百强校】重庆市第八中学2017-2018学年高一下学期期末考试化学试题【全国百强校】黑龙江省双鸭山市第一中学2018-2019学年高二上学期开学考试化学试题(已下线)2018年12月2日 《每日一题》人教选修4 - 每周一测(已下线)考点09 原电池原理及其应用——备战2019年浙江新高考化学考点(已下线)2019年3月23日 《每日一题》 必修2 周末培优广西壮族自治区柳州高中2018-2019学年高一(文)下学期期中考试化学试题河北省张家口一中2019-2020学年高二(衔接班)上学期入学考试化学试题吉林省长春外国语学校2019-2020学年高二上学期第一次月考化学试题上海市上海中学2016-2017学年高一下学期化学单元测试:电解质溶液上海市浦东新区2017年高考化学二模试卷黑龙江省绥化市安达市第七中学2019-2020学年高二上学期月考化学试题上海市金山中学2016届高三上学期开学化学试题(已下线)上海市十二校2012-2013学年高三上学期联考化学试题(已下线)上海市十校2012-2013学年高三上学期联考化学试题辽宁省营口市部分重点高中2017-2018学年高一下学期期末考试化学试题山西省朔州市应县第一中学校2019-2020学年高一下学期期中考试化学试题贵州省兴仁市凤凰中学2019-2020学年高一下学期期末考试化学试题河南省鹤壁市外国语中学2019-2020学年高一下学期段考化学试题福建省连城县第一中学2020-2021学年高二上学期第一次月考化学试题福建省三明市泰宁第一中学2020-2021学年高二上学期学分认定暨第一次阶段考试化学试题福建省莆田第十五中学2018-2019学年高二上学期期中考试化学试题西藏自治区拉萨市那曲第二高级中学2019-2020学年高一下学期期末考试化学试题江西省抚州市南城一中2020-2021学年高一下学期4月月考化学试题山东省郯城第二中学2020-2021学年下学期高一4月月考化学试题黑龙江省鹤岗市第一中学2020-2021学年高一下学期期中考试化学试题河北省辛集中学2020-2021学年高二下学期期中考试化学试题河北省辛集中学2020-2021学年高一下学期期中考试化学试题黑龙江省绥化市明水县第一中学2020-2021学年高一下学期第二次月考化学试题(已下线)考点21 原电池 化学电源-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点21 原电池 化学电源-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)4.1.1 原电池的工作原理(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)甘肃省永昌县第一高级中学2020-2021学年高二上学期期末考试化学试题山东省烟台市第二中学2021-2022学年高一下学期4月月考化学试题上海市同济中学2021-2022学年高一下学期期末考试化学试卷 (已下线)考点18 原电池 化学电源-备战2023年高考化学一轮复习考点帮(全国通用)河南省三门峡市渑池县第二高级中学2021-2022学年高二上学期第二次月考化学试题山西省怀仁市大地中学高中部2021-2022学年高一下学期5月月考化学试题江西省上饶市2019-2020学年高一下学期期末教学质量测试化学试题云南省楚雄州楚雄市天人中学2022-2023学年高二12月月考化学试题第2课时 化学反应与电能1(已下线)热点05 化学能与电能
7 . 中科院科学家设计出一套利用SO2和太阳能综合制氢方案,其基本工作原理如图所示,下列说法错误的是
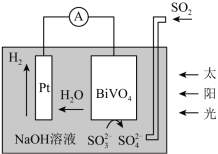
| A.该装置实现了太阳能转化为化学能 |
| B.Pt电极作正极,发生还原反应 |
| C.电子流向:Pt电极→外电路→BiVO4电极 |
D.BiVO4电极上的反应为SO -2e-+2OH-=SO -2e-+2OH-=SO +H2O +H2O |
您最近一年使用:0次
2023-11-01更新
|
332次组卷
|
2卷引用:广东省惠州市2023-2024学年高三上学期第二次调研考试化学试题
解题方法
8 . 一种新型 水介质电池示意图如图所示,电极为金属锌和选择性催化材料,放电时,温室气体
水介质电池示意图如图所示,电极为金属锌和选择性催化材料,放电时,温室气体 被转化为储氢物质甲酸(HCOOH)。下列说法正确的是
被转化为储氢物质甲酸(HCOOH)。下列说法正确的是
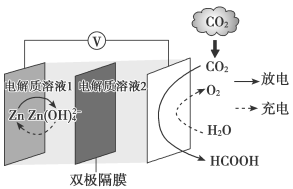
 水介质电池示意图如图所示,电极为金属锌和选择性催化材料,放电时,温室气体
水介质电池示意图如图所示,电极为金属锌和选择性催化材料,放电时,温室气体 被转化为储氢物质甲酸(HCOOH)。下列说法正确的是
被转化为储氢物质甲酸(HCOOH)。下列说法正确的是
A.放电时,负极反应为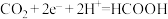 |
B.放电时, 转化为HCOOH,转移的电子数为4mol 转化为HCOOH,转移的电子数为4mol |
| C.充电时,Zn电极连接电源正极 |
D.充电时,电解质溶液2中 浓度降低 浓度降低 |
您最近一年使用:0次
9 . 氧化还原反应可拆分为氧化和还原两个“半反应”。某小组同学从“半反应”的角度探究反应规律。
(1)已知:IO +I-→I2的转化在酸性条件下才能发生。
+I-→I2的转化在酸性条件下才能发生。
①该转化的还原半反应是2IO +10e-+12H+=I2+6H2O,则相应的氧化半反应是
+10e-+12H+=I2+6H2O,则相应的氧化半反应是_______ 。
②分析上述还原半反应可知:增大c(H+)可促进IO 得到电子,使其
得到电子,使其_______ 性增强,进而与I-发生反应
(2)探究Cu与浓盐酸能否发生反应。
①有同学认为Cu与浓盐酸不能发生反应产生氢气,其依据是_______ 。
用如下装置进行实验[硫酸与浓盐酸中c(H+)接近]。
②甲是对比实验,目的是排除_______ 的干扰。
③a.丙中气球变鼓是因为生成了_______ 气体(填化学式)。
b.经检测,丙中反应后溶液中存在[CuCl4]3-。从氧化还原性的角度分析丙中反应能够发生的原因:_______ 。
(3)探究以下原电池的工作原理。
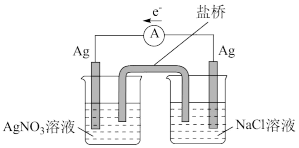
实验结果:产生电流,左侧Ag电极表面有Ag析出。右侧Ag电极周围生成AgCl。
①该装置中右侧Ag电极作_______ (填“正”或“负”)极。
②对该原电池的电极反应和总反应的反应类型进行分析,谈谈对原电池工作原理的认识:_______ 。
(1)已知:IO
 +I-→I2的转化在酸性条件下才能发生。
+I-→I2的转化在酸性条件下才能发生。①该转化的还原半反应是2IO
 +10e-+12H+=I2+6H2O,则相应的氧化半反应是
+10e-+12H+=I2+6H2O,则相应的氧化半反应是②分析上述还原半反应可知:增大c(H+)可促进IO
 得到电子,使其
得到电子,使其(2)探究Cu与浓盐酸能否发生反应。
①有同学认为Cu与浓盐酸不能发生反应产生氢气,其依据是
用如下装置进行实验[硫酸与浓盐酸中c(H+)接近]。
| 装置 | 序号 | 试管内药品 | 现象 |
 | 甲 | 浓盐酸 | 24小时后仍无明显变化 |
| 乙 | Cu粉+硫酸 | 24小时后仍无明显变化 | |
| 丙 | Cu粉+浓盐酸 | 24小时后气球变鼓 |
③a.丙中气球变鼓是因为生成了
b.经检测,丙中反应后溶液中存在[CuCl4]3-。从氧化还原性的角度分析丙中反应能够发生的原因:
(3)探究以下原电池的工作原理。

实验结果:产生电流,左侧Ag电极表面有Ag析出。右侧Ag电极周围生成AgCl。
①该装置中右侧Ag电极作
②对该原电池的电极反应和总反应的反应类型进行分析,谈谈对原电池工作原理的认识:
您最近一年使用:0次
名校
解题方法
10 . 2021年我国科研人员以二硫化钼(MoS2)作为电极催化剂,研发出一种Zn-NO电池系统,该电池同时具备合成氨和对外供电的功能,其工作原理如图所示。已知双极膜可将水解离为H+和OH—,并实现其定向通过,则下列说法错误的是
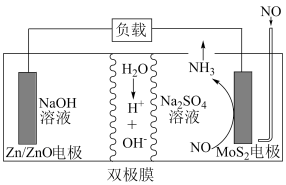
| A.Zn/ZnO电极电势要比MoS2电极电势低 |
| B.双极膜的存在能保证两侧电解质溶液的浓度不变 |
| C.Zn/ZnO电极表面发生的反应为Zn-2e—+2OH—=ZnO+H2O |
| D.当电路通过1mol e—时,整个电池系统质量会增大2.6 g |
您最近一年使用:0次
2023-02-15更新
|
309次组卷
|
2卷引用:广东省深圳市深圳实验学校高中部2022-2023学年高二上学期第三阶段考试化学试题



