江苏省新高考基地学校2022-2023学年高三下学期3月大联考化学试题
江苏
高三
阶段练习
2023-03-13
1004次
整体难度:
适中
考查范围:
有机化学基础、化学与STSE、物质结构与性质、常见无机物及其应用、化学反应原理、认识化学科学、化学实验基础
江苏省新高考基地学校2022-2023学年高三下学期3月大联考化学试题
江苏
高三
阶段练习
2023-03-13
1004次
整体难度:
适中
考查范围:
有机化学基础、化学与STSE、物质结构与性质、常见无机物及其应用、化学反应原理、认识化学科学、化学实验基础
一、单选题 添加题型下试题
单选题
|
适中(0.65)
2. 乙醛常用于有机合成,由乙醇催化氧化制取乙醛的反应如下: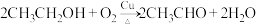 。下列说法正确的是
。下列说法正确的是
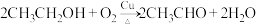 。下列说法正确的是
。下列说法正确的是A.相同条件下, 的沸点高于 的沸点高于 |
B.基态Cu的核外电子排布式为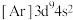 |
C.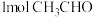 中所含 中所含 键的数目为5mol 键的数目为5mol |
D. 是由极性键构成的非极性分子 是由极性键构成的非极性分子 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
3. 下列有关物质的性质与用途具有对应关系的是
| A.氧化铁能与酸反应,可用作红色颜料 | B.次氯酸具有弱酸性,可用作漂白剂 |
| C.银氨溶液具有弱氧化性,可用于制银镜 | D.晶体硅熔点高,可用作半导体材料 |
您最近一年使用:0次
2023-03-10更新
|
330次组卷
|
2卷引用:江苏省新高考基地学校2022-2023学年高三下学期3月大联考化学试题
单选题
|
适中(0.65)
解题方法
4. X、Y、Z、W、R属于周期表中前20号主族元素,且原子序数依次增大。基态X原子2p轨道半充满,Z是元素周期表中电负性最大的元素,Z和W同主族,R的最外层只有1个电子。下列说法正确的是
| A.X的简单氢化物分子间能形成氢键 | B.简单离子半径: |
| C.简单气态氢化物的热稳定性:W>Z | D.第一电离能: |
您最近一年使用:0次
2023-03-10更新
|
323次组卷
|
2卷引用:江苏省新高考基地学校2022-2023学年高三下学期3月大联考化学试题
单选题
|
适中(0.65)
5. 侯氏制碱法以氯化钠、二氧化碳、氨和水为原料,发生反应 。将析出的固体灼烧获取纯碱,向析出固体后的母液中加入食盐可获得副产品氯化铵。下列制纯碱的实验原理与装置
。将析出的固体灼烧获取纯碱,向析出固体后的母液中加入食盐可获得副产品氯化铵。下列制纯碱的实验原理与装置不能 达到实验目的的是
 。将析出的固体灼烧获取纯碱,向析出固体后的母液中加入食盐可获得副产品氯化铵。下列制纯碱的实验原理与装置
。将析出的固体灼烧获取纯碱,向析出固体后的母液中加入食盐可获得副产品氯化铵。下列制纯碱的实验原理与装置
| A.用装置甲制取氨气 | B.用装置乙制取碳酸氢钠 |
| C.用装置丙过滤得到碳酸氢钠固体 | D.用装置丁加热分解碳酸氢钠得到纯碱 |
您最近一年使用:0次
2023-03-10更新
|
333次组卷
|
2卷引用:江苏省新高考基地学校2022-2023学年高三下学期3月大联考化学试题
单选题
|
适中(0.65)
6. 侯氏制碱法以氯化钠、二氧化碳、氨和水为原料,发生反应 。将析出的固体灼烧获取纯碱,向析出固体后的母液中加入食盐可获得副产品氯化铵。下列有关说法正确的是
。将析出的固体灼烧获取纯碱,向析出固体后的母液中加入食盐可获得副产品氯化铵。下列有关说法正确的是
 。将析出的固体灼烧获取纯碱,向析出固体后的母液中加入食盐可获得副产品氯化铵。下列有关说法正确的是
。将析出的固体灼烧获取纯碱,向析出固体后的母液中加入食盐可获得副产品氯化铵。下列有关说法正确的是A.固态 为共价晶体 为共价晶体 |
B. 中心原子采取 中心原子采取 杂化 杂化 |
C. 转变为 转变为 过程中键角变大 过程中键角变大 |
D.相同温度下, 在水中的溶解度小于在NaCl溶液中的溶解度 在水中的溶解度小于在NaCl溶液中的溶解度 |
您最近一年使用:0次
单选题
|
适中(0.65)
7. 侯氏制碱法以氯化钠、二氧化碳、氨和水为原料,发生反应 。将析出的固体灼烧获取纯碱,向析出固体后的母液中加入食盐可获得副产品氯化铵。通过以下两步反应可实现
。将析出的固体灼烧获取纯碱,向析出固体后的母液中加入食盐可获得副产品氯化铵。通过以下两步反应可实现 分解产物的分离。
分解产物的分离。
反应I:

反应II:

下列说法不正确的是
 。将析出的固体灼烧获取纯碱,向析出固体后的母液中加入食盐可获得副产品氯化铵。通过以下两步反应可实现
。将析出的固体灼烧获取纯碱,向析出固体后的母液中加入食盐可获得副产品氯化铵。通过以下两步反应可实现 分解产物的分离。
分解产物的分离。反应I:


反应II:


下列说法不正确的是

A.反应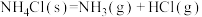 能自发的主要原因是 能自发的主要原因是 |
B.反应I的平衡常数可表达为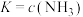 |
| C.升高温度,反应II中v(逆)增大 |
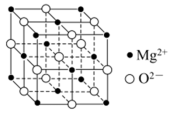
D.如图所示的MgO晶胞中距离 最近的 最近的 有4个 有4个 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
8. 一种新型 水介质电池示意图如图所示,电极为金属锌和选择性催化材料,放电时,温室气体
水介质电池示意图如图所示,电极为金属锌和选择性催化材料,放电时,温室气体 被转化为储氢物质甲酸(HCOOH)。下列说法正确的是
被转化为储氢物质甲酸(HCOOH)。下列说法正确的是
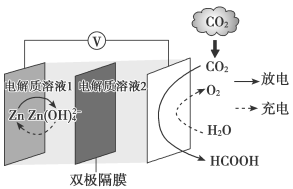
 水介质电池示意图如图所示,电极为金属锌和选择性催化材料,放电时,温室气体
水介质电池示意图如图所示,电极为金属锌和选择性催化材料,放电时,温室气体 被转化为储氢物质甲酸(HCOOH)。下列说法正确的是
被转化为储氢物质甲酸(HCOOH)。下列说法正确的是
A.放电时,负极反应为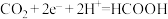 |
B.放电时, 转化为HCOOH,转移的电子数为4mol 转化为HCOOH,转移的电子数为4mol |
| C.充电时,Zn电极连接电源正极 |
D.充电时,电解质溶液2中 浓度降低 浓度降低 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
9. 由苯甲醛制备重要的有机合成中间体的一种反应如下:
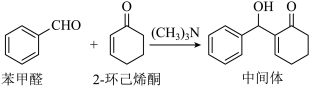
| A.该反应属于取代反应 |
| B.可用少量酸性高锰酸钾鉴别苯甲醛和2-环己烯酮 |
| C.2-环己烯酮中所有的原子可能共平面 |
D.中间体与足量 完全加成后所得分子中含有3个手性碳原子 完全加成后所得分子中含有3个手性碳原子 |
您最近一年使用:0次
2023-03-10更新
|
662次组卷
|
3卷引用:江苏省新高考基地学校2022-2023学年高三下学期3月大联考化学试题
单选题
|
适中(0.65)
名校
解题方法
10. 现用菱锰矿(主要成分 ,含有
,含有 、
、 、
、 、
、 )为原料制备
)为原料制备 的流程如下:
的流程如下:
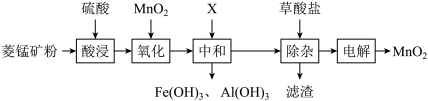
下列说法正确的是
 ,含有
,含有 、
、 、
、 、
、 )为原料制备
)为原料制备 的流程如下:
的流程如下:
下列说法正确的是
| A.将菱锰矿粉碎所使用的化学仪器为坩埚 |
B.“氧化”时发生的离子方程式为: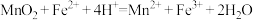 |
C.“中和”时加入的物质X可以是 |
D.“电解”时 在阴极生成,过程中同时生成可循环利用的物质 在阴极生成,过程中同时生成可循环利用的物质 |
您最近一年使用:0次
2023-03-10更新
|
554次组卷
|
4卷引用:江苏省新高考基地学校2022-2023学年高三下学期3月大联考化学试题
单选题
|
适中(0.65)
11. 室温下,下列实验探究方案能达到探究目的的是
| 选项 | 探究方案 | 探究目的 |
| A | 在 中加入浓盐酸,并将反应后的气体直接通入苯酚钠溶液中,观察现象 中加入浓盐酸,并将反应后的气体直接通入苯酚钠溶液中,观察现象 | 酸性:碳酸>苯酚 |
| B | 向试管加入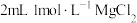 溶液,滴加 溶液,滴加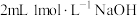 溶液,再滴加几滴 溶液,再滴加几滴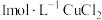 ,观察现象 ,观察现象 | 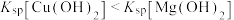 |
| C | 向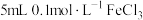 溶液中滴加 溶液中滴加 溶液,充分反应后再滴加几滴KSCN溶液,观察溶液颜色变化 溶液,充分反应后再滴加几滴KSCN溶液,观察溶液颜色变化 |  和KI反应为可逆反应 和KI反应为可逆反应 |
| D | 用pH计测量醋酸、盐酸的pH,比较溶液pH大小 |  是弱电解质 是弱电解质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
12. 氢硫酸是一种弱酸(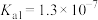 、
、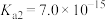 )。下列说法正确的是
)。下列说法正确的是
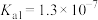 、
、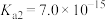 )。下列说法正确的是
)。下列说法正确的是A.用 吸收 吸收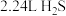 (标况)所得溶液中: (标况)所得溶液中: |
B.用NaOH吸收 后的溶液中 后的溶液中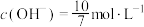 ,则 ,则 |
C. 溶液吸收少量 溶液吸收少量 气体,产生黑色沉淀,上层清液中: 气体,产生黑色沉淀,上层清液中: |
D.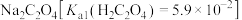 能与 能与 发生反应: 发生反应: |
您最近一年使用:0次
2023-03-10更新
|
341次组卷
|
2卷引用:江苏省新高考基地学校2022-2023学年高三下学期3月大联考化学试题
单选题
|
较难(0.4)
名校
13. 在某催化剂作用下 和
和 合成甲醇涉及以下反应:
合成甲醇涉及以下反应:
I.

II.

在恒容密闭容器中, 和
和 分别投
分别投 、
、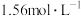 发生反应,平衡时
发生反应,平衡时 的转化率及
的转化率及 和CO的选择性([
和CO的选择性([ %]随温度变化如图所示。下列说法正确的是
%]随温度变化如图所示。下列说法正确的是

 和
和 合成甲醇涉及以下反应:
合成甲醇涉及以下反应:I.


II.


在恒容密闭容器中,
 和
和 分别投
分别投 、
、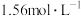 发生反应,平衡时
发生反应,平衡时 的转化率及
的转化率及 和CO的选择性([
和CO的选择性([ %]随温度变化如图所示。下列说法正确的是
%]随温度变化如图所示。下列说法正确的是
A.同时提高 的平衡转化率和平衡时 的平衡转化率和平衡时 的选择性应选择在高温条件下反应 的选择性应选择在高温条件下反应 |
| B.600℃后,升高温度对反应I的影响程度大于反应II |
C.开发低温时的高效催化剂,可以提高 的平衡转化率 的平衡转化率 |
D.720℃时,反应I的平衡常数 |
您最近一年使用:0次
2023-03-10更新
|
553次组卷
|
3卷引用:江苏省新高考基地学校2022-2023学年高三下学期3月大联考化学试题
二、解答题 添加题型下试题
解答题-工业流程题
|
较难(0.4)
14. 从铜烟灰酸浸渣(主要含PbO、 、
、 、
、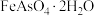 中提取铟的工艺如图所示:
中提取铟的工艺如图所示:

已知:①焙烧后金属元素均以硫酸盐的形式存在;
②25℃时, ,
,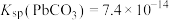 。
。
(1)“水浸”工艺中的滤渣除 外,还含有
外,还含有_______ 。
(2)“还原铁”中发生反应的离子方程式为_______ 。
(3)通过萃取除铁、反萃取、置换等过程,可制备金属铟。已知 能被有机萃取剂P204(简称
能被有机萃取剂P204(简称 )萃取,其萃取原理可表示为
)萃取,其萃取原理可表示为 (水层)
(水层)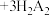 (有机层)
(有机层)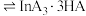 (有机层)
(有机层)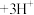 (水层)
(水层)
①研究表明,在此系列操作之前增加“还原铁”工艺,可延长有机相的使用寿命、提高铟产品的纯度,其原因可能是_______ 。
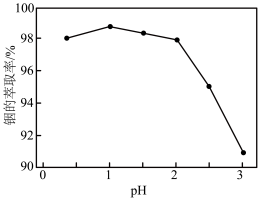
②实验证明,在有机相P204体积分数为55%,温度为25℃时,水相的pH对铟萃取率的影响如题图所示。结果表明, 时,铟萃取率开始下降,其原因是
时,铟萃取率开始下降,其原因是_______ 。
(4)滤渣中铅含量测定。准确称取滤渣样品4.460g,投入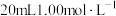 的
的 溶液浸泡,充分反应后抽滤。将所得滤饼投入
溶液浸泡,充分反应后抽滤。将所得滤饼投入 充分溶解,过滤,蒸馏水洗涤沉淀,并将洗涤液和滤液都转移至100.00mL容量瓶中定容。取25.00mL溶液,加入指示剂后用
充分溶解,过滤,蒸馏水洗涤沉淀,并将洗涤液和滤液都转移至100.00mL容量瓶中定容。取25.00mL溶液,加入指示剂后用 的EDTA标准溶液
的EDTA标准溶液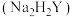 滴定至终点(离子方程式为
滴定至终点(离子方程式为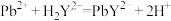 ),消耗EDTA标准液16.00mL,则滤渣中铅的质量分数(以PbO计)为
),消耗EDTA标准液16.00mL,则滤渣中铅的质量分数(以PbO计)为_______ (写出计算过程)。
 、
、 、
、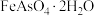 中提取铟的工艺如图所示:
中提取铟的工艺如图所示: 
已知:①焙烧后金属元素均以硫酸盐的形式存在;
②25℃时,
 ,
,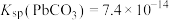 。
。(1)“水浸”工艺中的滤渣除
 外,还含有
外,还含有(2)“还原铁”中发生反应的离子方程式为
(3)通过萃取除铁、反萃取、置换等过程,可制备金属铟。已知
 能被有机萃取剂P204(简称
能被有机萃取剂P204(简称 )萃取,其萃取原理可表示为
)萃取,其萃取原理可表示为 (水层)
(水层)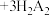 (有机层)
(有机层)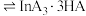 (有机层)
(有机层)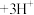 (水层)
(水层)①研究表明,在此系列操作之前增加“还原铁”工艺,可延长有机相的使用寿命、提高铟产品的纯度,其原因可能是
②实验证明,在有机相P204体积分数为55%,温度为25℃时,水相的pH对铟萃取率的影响如题图所示。结果表明,
 时,铟萃取率开始下降,其原因是
时,铟萃取率开始下降,其原因是
(4)滤渣中铅含量测定。准确称取滤渣样品4.460g,投入
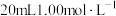 的
的 溶液浸泡,充分反应后抽滤。将所得滤饼投入
溶液浸泡,充分反应后抽滤。将所得滤饼投入 充分溶解,过滤,蒸馏水洗涤沉淀,并将洗涤液和滤液都转移至100.00mL容量瓶中定容。取25.00mL溶液,加入指示剂后用
充分溶解,过滤,蒸馏水洗涤沉淀,并将洗涤液和滤液都转移至100.00mL容量瓶中定容。取25.00mL溶液,加入指示剂后用 的EDTA标准溶液
的EDTA标准溶液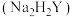 滴定至终点(离子方程式为
滴定至终点(离子方程式为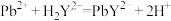 ),消耗EDTA标准液16.00mL,则滤渣中铅的质量分数(以PbO计)为
),消耗EDTA标准液16.00mL,则滤渣中铅的质量分数(以PbO计)为
您最近一年使用:0次
解答题-有机推断题
|
较难(0.4)
解题方法
15. 罗匹尼罗是一种抗帕金森病药物,其合成路线如下:
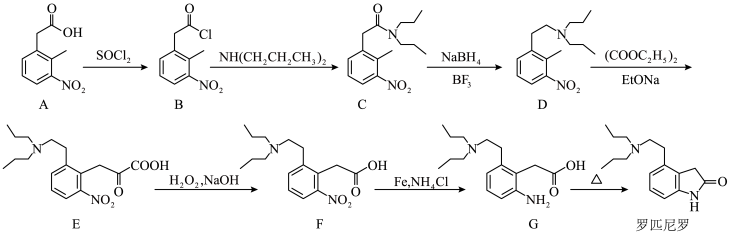
(1)下列关于罗匹尼罗的说法正确的是_______ 。
A.分子式是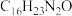 B.可制成盐酸盐,增强水溶性 C.采取
B.可制成盐酸盐,增强水溶性 C.采取 杂化的C原子数为8
杂化的C原子数为8
(2)C→D的反应类型为_______ 。
(3)已知D与 的反应类型是取代反应,则除E外的另一种产物为
的反应类型是取代反应,则除E外的另一种产物为_______ 。
(4)A的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_______ 。
①能发生银镜反应和水解反应。
②分子中有3种不同化学环境的氢。
(5)写出以 和
和 为原料制备
为原料制备 的合成路线流程图
的合成路线流程图_______ (无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。

(1)下列关于罗匹尼罗的说法正确的是
A.分子式是
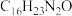 B.可制成盐酸盐,增强水溶性 C.采取
B.可制成盐酸盐,增强水溶性 C.采取 杂化的C原子数为8
杂化的C原子数为8(2)C→D的反应类型为
(3)已知D与
 的反应类型是取代反应,则除E外的另一种产物为
的反应类型是取代反应,则除E外的另一种产物为(4)A的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
①能发生银镜反应和水解反应。
②分子中有3种不同化学环境的氢。
(5)写出以
 和
和 为原料制备
为原料制备 的合成路线流程图
的合成路线流程图
您最近一年使用:0次
解答题-工业流程题
|
较难(0.4)
名校
解题方法
16. 氯化亚铜(CuCl)是重要的铜盐系列产品,某学习小组用海绵铜制取氯化亚铜的流程如下:
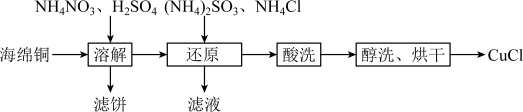
CuCl难溶于水和乙醇,易溶于 浓度较大的体系
浓度较大的体系 。
。
Ⅰ.海绵铜的溶解
经观察,海绵铜(主要成分是Cu和CuO)在“溶解”过程中未产生气泡,反应原理为:
反应①: (较快);
(较快);
反应②:_______(较慢)。
(1)写出反应②的化学方程式_______ 。
(2)实验过程中,测得不同温度下浸出液中 的质量浓度如图1所示。图中显示在第1h内铜的浸出率较大,其原因是
的质量浓度如图1所示。图中显示在第1h内铜的浸出率较大,其原因是_______ 。

Ⅱ.氯化亚铜的制备
利用海绵铜“溶解”后的溶液与 、
、 反应,可制备氯化亚铜,装置如图2所示。
反应,可制备氯化亚铜,装置如图2所示。

(3)“还原”过程中一般采用 最为适宜,原因是
最为适宜,原因是_______ 。
(4)下表是氯化铵用量 与
与 沉淀率的关系如下表所示,
沉淀率的关系如下表所示, 沉淀率在比值为1.1时最大的原因是
沉淀率在比值为1.1时最大的原因是_______ 。
(5)“酸洗”步骤中,最合适选用的试剂是_______ (写酸的名称)。
Ⅲ.氯化亚铜的提纯
(6)已知: 水解可生成CuCl。温度、pH对CuCl产率的影响如下图所示。
水解可生成CuCl。温度、pH对CuCl产率的影响如下图所示。

请根据以上信息,设计由CuCl、Cu和CuO的混合固体中提纯CuCl的实验方案:_______ 。(实验中须使用的试剂与仪器:饱和NaCl溶液、 的
的 溶液、乙醇、真空干燥箱)
溶液、乙醇、真空干燥箱)

CuCl难溶于水和乙醇,易溶于
 浓度较大的体系
浓度较大的体系 。
。Ⅰ.海绵铜的溶解
经观察,海绵铜(主要成分是Cu和CuO)在“溶解”过程中未产生气泡,反应原理为:
反应①:
 (较快);
(较快);反应②:_______(较慢)。
(1)写出反应②的化学方程式
(2)实验过程中,测得不同温度下浸出液中
 的质量浓度如图1所示。图中显示在第1h内铜的浸出率较大,其原因是
的质量浓度如图1所示。图中显示在第1h内铜的浸出率较大,其原因是
Ⅱ.氯化亚铜的制备
利用海绵铜“溶解”后的溶液与
 、
、 反应,可制备氯化亚铜,装置如图2所示。
反应,可制备氯化亚铜,装置如图2所示。
(3)“还原”过程中一般采用
 最为适宜,原因是
最为适宜,原因是(4)下表是氯化铵用量
 与
与 沉淀率的关系如下表所示,
沉淀率的关系如下表所示, 沉淀率在比值为1.1时最大的原因是
沉淀率在比值为1.1时最大的原因是 | 0.8 | 0.9 | 1.0 | 1.1 | 1.2 | 1.3 |
 沉淀率/% 沉淀率/% | 35.3 | 73.2 | 85.2 | 91.3 | 79.2 | 65.4 |
Ⅲ.氯化亚铜的提纯
(6)已知:
 水解可生成CuCl。温度、pH对CuCl产率的影响如下图所示。
水解可生成CuCl。温度、pH对CuCl产率的影响如下图所示。
请根据以上信息,设计由CuCl、Cu和CuO的混合固体中提纯CuCl的实验方案:
 的
的 溶液、乙醇、真空干燥箱)
溶液、乙醇、真空干燥箱)
您最近一年使用:0次
2023-03-10更新
|
577次组卷
|
3卷引用:江苏省新高考基地学校2022-2023学年高三下学期3月大联考化学试题
解答题-原理综合题
|
较难(0.4)
名校
17. 铁元素的纳米材料因具备良好的电学特性和磁学特性,而引起了广泛的研究。纳米零价铁可用于去除水体中的六价铬[Cr(VI)]与硝酸盐等污染物。
(1)①用 溶液与
溶液与 (H元素为-1价)溶液反应制备纳米零价铁的化学方程式:
(H元素为-1价)溶液反应制备纳米零价铁的化学方程式: 。当生成1mol Fe时,反应中转移电子的物质的量为
。当生成1mol Fe时,反应中转移电子的物质的量为_______ 。
②纳米Fe和 均可用于降解含
均可用于降解含 的废水。实验证明
的废水。实验证明 辅助纳米铁去除
辅助纳米铁去除 效果更佳,结合图1,分析其原因是
效果更佳,结合图1,分析其原因是_______ 。 时正极电极反应式为
时正极电极反应式为_______ 。
(3)利用纳米铁粉去除水体中的Cr(VI)反应机理如图2所示。_______ 。
②为了考察溶解氧对水体中的Cr(VI)去除率的影响,实验小组设计了一组对比实验,其中一组在反应中通入 ,另一组不通入
,另一组不通入 。结果表明,实验初期,通入
。结果表明,实验初期,通入 的去除率远高于未通
的去除率远高于未通 的,其原因可能是
的,其原因可能是_______ 。
③某水样Cr(VI)的初始浓度为 ,在相同条件下,探讨了温度为15℃、25℃、35℃、45℃对Cr(Ⅵ)的去除率的影响,结果如图3所示,由图可知,温度在25℃时,去除率最高,其原因是
,在相同条件下,探讨了温度为15℃、25℃、35℃、45℃对Cr(Ⅵ)的去除率的影响,结果如图3所示,由图可知,温度在25℃时,去除率最高,其原因是_______ 。
(1)①用
 溶液与
溶液与 (H元素为-1价)溶液反应制备纳米零价铁的化学方程式:
(H元素为-1价)溶液反应制备纳米零价铁的化学方程式: 。当生成1mol Fe时,反应中转移电子的物质的量为
。当生成1mol Fe时,反应中转移电子的物质的量为②纳米Fe和
 均可用于降解含
均可用于降解含 的废水。实验证明
的废水。实验证明 辅助纳米铁去除
辅助纳米铁去除 效果更佳,结合图1,分析其原因是
效果更佳,结合图1,分析其原因是
 时正极电极反应式为
时正极电极反应式为(3)利用纳米铁粉去除水体中的Cr(VI)反应机理如图2所示。

②为了考察溶解氧对水体中的Cr(VI)去除率的影响,实验小组设计了一组对比实验,其中一组在反应中通入
 ,另一组不通入
,另一组不通入 。结果表明,实验初期,通入
。结果表明,实验初期,通入 的去除率远高于未通
的去除率远高于未通 的,其原因可能是
的,其原因可能是③某水样Cr(VI)的初始浓度为
 ,在相同条件下,探讨了温度为15℃、25℃、35℃、45℃对Cr(Ⅵ)的去除率的影响,结果如图3所示,由图可知,温度在25℃时,去除率最高,其原因是
,在相同条件下,探讨了温度为15℃、25℃、35℃、45℃对Cr(Ⅵ)的去除率的影响,结果如图3所示,由图可知,温度在25℃时,去除率最高,其原因是
您最近一年使用:0次
2023-03-10更新
|
953次组卷
|
3卷引用:江苏省新高考基地学校2022-2023学年高三下学期3月大联考化学试题
试卷分析
整体难度:适中
考查范围:有机化学基础、化学与STSE、物质结构与性质、常见无机物及其应用、化学反应原理、认识化学科学、化学实验基础
试卷题型(共 17题)
题型
数量
单选题
13
解答题
4
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 淀粉和纤维素 蛋白质 合成纤维 | |
| 2 | 0.65 | 电子排布式 物质结构中化学键数目的计算 极性分子和非极性分子 氢键对物质性质的影响 | |
| 3 | 0.65 | 次氯酸及其性质 硅的物理性质与用途 几种铁的氧化物的物理性质及用途 乙醛的银镜反应 | |
| 4 | 0.65 | 同主族元素性质递变规律理解及应用 微粒半径大小的比较方法 根据原子结构进行元素种类推断 电离能变化规律 | |
| 5 | 0.65 | 纯碱的生产 | |
| 6 | 0.65 | 键能、键长、键角及应用 利用杂化轨道理论判断分子的空间构型 | |
| 7 | 0.65 | 温度对化学反应速率的影响 化学平衡常数的概念及表达方式 复合判据 晶胞 | |
| 8 | 0.65 | 原电池正负极判断 原电池电极反应式书写 电解原理的理解及判断 原电池、电解池综合考查 | |
| 9 | 0.65 | 有机官能团的性质及结构 分子的手性 有机分子中原子共面的判断 醛基的加成反应 | |
| 10 | 0.65 | 氧化还原反应方程式的书写与配平 电解原理的理解及判断 物质分离、提纯综合应用 常见无机物的制备 | |
| 11 | 0.65 | 沉淀转化 苯酚的弱酸性 | |
| 12 | 0.85 | 弱电解质在水溶液中的电离平衡 盐溶液中离子浓度大小的比较 溶度积规则及其应用 | |
| 13 | 0.4 | 化学平衡的移动及其影响因素 化学平衡图像分析 化学平衡常数的有关计算 | |
| 二、解答题 | |||
| 14 | 0.4 | 有关铁及其化合物转化的流程题型 物质分离、提纯综合应用 物质含量的测定 | 工业流程题 |
| 15 | 0.4 | 根据要求书写同分异构体 根据题给物质选择合适合成路线 多官能团有机物的结构与性质 有机推断综合考查 | 有机推断题 |
| 16 | 0.4 | 化学平衡的移动及其影响因素 沉淀的溶解与生成 常见无机物的制备 | 工业流程题 |
| 17 | 0.4 | 氧化还原反应有关计算 化学反应原理综合考查 原电池电极反应式书写 | 原理综合题 |



