名校
1 . 电浮选凝聚法处理酸性污水的工作原理如图所示。下列说法不正确的是
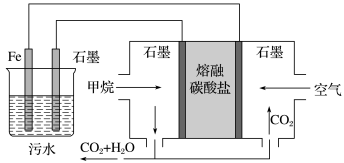

| A.铁电极的电极反应式为Fe-2e-=Fe2+ |
| B.污水中的阴离子向石墨电极移动 |
C.通入甲烷的石墨电极的电极反应式为CH4+4CO -8e-=5CO2+2H2O -8e-=5CO2+2H2O |
| D.为了增强污水的导电能力,可向污水中加入适量工业用食盐 |
您最近一年使用:0次
2021-03-11更新
|
289次组卷
|
3卷引用:甘肃省平凉市第二中学2022-2023学年高二上学期期末考试(延考)化学试题
名校
解题方法
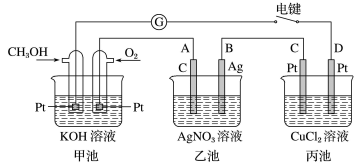
2 . 如图所示,其中甲池的总反应式:2CH3OH+3O2+4KOH=2K2CO3+6H2O。下列说法正确的是( )
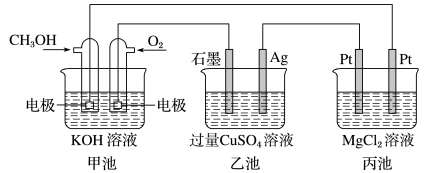

| A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化为电能的装置 |
B.甲池中通入CH3OH一极的电极反应为CH3OH-6e-+2H2O=CO +8H+ +8H+ |
| C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 |
| D.甲池中消耗1.12L(标准状况下)O2,此时丙池中理论上最多产生5.8固体 |
您最近一年使用:0次
2020-10-25更新
|
294次组卷
|
2卷引用:甘肃省天水市第一中学2020-2021学年高二下学期开学考试化学试题
名校
解题方法
3 . 如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时,M、N 两个电极的质量都不减少,下列说法正确的是( )
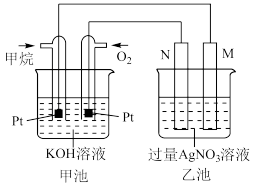

| A.N 电极的材料是Fe |
| B.甲烷在电极上发生的反应为 CH4+8OH--8e- ═ CO2+6H2O |
C.乙池的总反应是 4Ag++4OH-  4Ag +2H2O + O2↑ 4Ag +2H2O + O2↑ |
| D.乙池中电极析出金属银 0.02 mol 时,甲池中理论上消耗氧气为112mL(标准状况下) |
您最近一年使用:0次
2020-09-15更新
|
510次组卷
|
4卷引用:甘肃省静宁县第一中学2020-2021学年高一下学期第二次月考化学(实验班)试题
名校
解题方法
4 . 甲醇(CH3OH)是一种绿色能源。如图所示某同学设计一个甲醇燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.
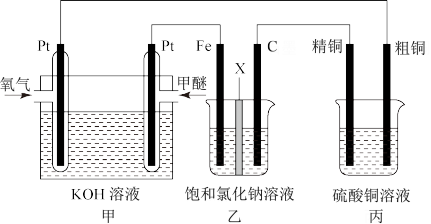
根据要求回答相关问题:
(1)写出负极的电极反应式为___________________
(2)铁电极为_______ (填“阳极或“阴极),石墨电极(C)的电极反应式为_________
(3)若在标准状况下,有2.24L氧气参加反应,丙装置中阴极析出铜的质量为_______ g
(4)若将乙装置中两电极与位置互换,其它装置不变,此时以装置中发生的总反应式______

根据要求回答相关问题:
(1)写出负极的电极反应式为
(2)铁电极为
(3)若在标准状况下,有2.24L氧气参加反应,丙装置中阴极析出铜的质量为
(4)若将乙装置中两电极与位置互换,其它装置不变,此时以装置中发生的总反应式
您最近一年使用:0次
名校
解题方法
5 . (1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为:Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。则正极的反应式是
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。则正极的反应式是___________ ,负极的反应式是___________ 。放电时负极附近的溶液的碱性________ (填“不变”、“变大”或“变小”)。
(2)一种熔融碳酸盐燃料电池原理示意如图所示:

电池工作时,外电路上电流的方向应从电极________ (填A或B)流向用电器。内电路中,CO32-向电极___________ (填A或B)移动,电极A上CO参与的电极反应为___________ 。
(3)将两铂片插入KOH溶液中作为电极,在两极区分别通入甲醇(CH3OH)和氧气构成燃料电池,则通入甲醇的电极是原电池的____ 极,该极的电极反应式是____________ ,通入氧气的电极是原电池的____ 极,电极反应式是___________________ 。如果消耗甲醇160 g,假设化学能完全转化为电能,则转移电子的数目为_______________ (用NA表示)。
 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。则正极的反应式是
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。则正极的反应式是(2)一种熔融碳酸盐燃料电池原理示意如图所示:

电池工作时,外电路上电流的方向应从电极
(3)将两铂片插入KOH溶液中作为电极,在两极区分别通入甲醇(CH3OH)和氧气构成燃料电池,则通入甲醇的电极是原电池的
您最近一年使用:0次
解题方法
6 . 某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到检流计的指针发生了偏转。
请回答下列问题:
 甲池为
甲池为________  填“原电池”“电解池”或“电镀池”
填“原电池”“电解池”或“电镀池” ,通入
,通入 电极的电极反应式为
电极的电极反应式为__________ 。
 乙池中
乙池中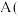 石墨
石墨 电极的名称为
电极的名称为________  填“正极”“负极”“阴极”或“阳极”
填“正极”“负极”“阴极”或“阳极” ,总反应式为
,总反应式为_______ 。
 当乙池中B极质量增加
当乙池中B极质量增加 时,甲池中理论上消耗
时,甲池中理论上消耗 的体积为
的体积为________ 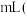 标准状况下
标准状况下 ,丙池中
,丙池中________ 极析出________ g铜。电键闭合一段时间后,甲中溶液的pH将________  填“增大”“减小”或“不变”
填“增大”“减小”或“不变” 。
。

请回答下列问题:
 甲池为
甲池为 填“原电池”“电解池”或“电镀池”
填“原电池”“电解池”或“电镀池” ,通入
,通入 电极的电极反应式为
电极的电极反应式为 乙池中
乙池中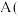 石墨
石墨 电极的名称为
电极的名称为 填“正极”“负极”“阴极”或“阳极”
填“正极”“负极”“阴极”或“阳极” ,总反应式为
,总反应式为 当乙池中B极质量增加
当乙池中B极质量增加 时,甲池中理论上消耗
时,甲池中理论上消耗 的体积为
的体积为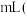 标准状况下
标准状况下 ,丙池中
,丙池中 填“增大”“减小”或“不变”
填“增大”“减小”或“不变” 。
。
您最近一年使用:0次
2020-02-04更新
|
76次组卷
|
2卷引用:甘肃省会宁县第三中学2021-2022学年高三上学期第三次月考化学试题
名校
7 . (1)铅蓄电池是典型的可充型电池,请回答下列问题(不考虑氢、氧的氧化还原):放电时,正极的电极反应式是____________ ;电解液中H2SO4的浓度将_______ (填变小、变大或不变);当外电路通过0.5 mol电子时,理论上负极板的质量增加__________ g。
(2)用甲醇燃料电池电解AgNO3溶液,如图所示,回答下列问题:

①甲池是________ 装置;通入CH3OH的电极名称是______ ,
②写出通入O2的电极的电极反应式是________________ 。
③A电极的电极反应式为_________________________ 。
④当乙池中A(Fe)极的质量增加2.70 g时,甲池中理论上消耗O2_____ mL(标准状况下)
(2)用甲醇燃料电池电解AgNO3溶液,如图所示,回答下列问题:

①甲池是
②写出通入O2的电极的电极反应式是
③A电极的电极反应式为
④当乙池中A(Fe)极的质量增加2.70 g时,甲池中理论上消耗O2
您最近一年使用:0次
2020-01-10更新
|
150次组卷
|
2卷引用:甘肃省庆阳市第六中学2020-2021学年高二上学期期末考试化学试题
10-11高三·甘肃·阶段练习
8 . 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
(1)合成甲醇的反应为:CO(g)+2H2(g)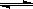 CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H
CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H__________ 0。(填“>、<或=”下同)
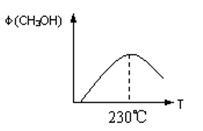
(2)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的__________ 倍。
(3)利用甲醇燃料电池设计如图所示的装置:
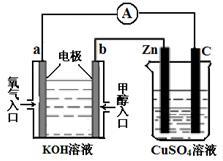
①则该装置中b为____________ 极,写出装置中电解池内发生反应的离子方程式_______________________ 。
②当锌片的质量变化为12.8 g时,a极上消耗的O2 在标准状况下的体积为___________ L。
(4)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)= C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l)= C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方程式____________________________________ 。
(1)合成甲醇的反应为:CO(g)+2H2(g)
 CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H
CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H
(2)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的
(3)利用甲醇燃料电池设计如图所示的装置:

①则该装置中b为
②当锌片的质量变化为12.8 g时,a极上消耗的O2 在标准状况下的体积为
(4)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)= C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l)= C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方程式
您最近一年使用:0次
9 . 甲醇(CH3OH)是重要的溶剂和替代燃料,工业常以CO和H2的混合气体为原料一定条件下制备甲醇。
(1)甲醇与乙醇互为________ ;完全燃烧时,甲醇与同物质的量的汽油(设平均组成为C8H18)消耗O2量之比为________ 。
(2)工业上还可以通过下列途径获得H2,其中节能效果最好的是________ 。
A. 高温分解水制取H2:2H2O 2H2↑+ O2↑
2H2↑+ O2↑
B. 电解水制取H2:2H2O 2H2↑+ O2↑
2H2↑+ O2↑
C. 甲烷与水反应制取H2:CH4 + H2O 3H2 + CO
3H2 + CO
D. 在光催化剂作用下,利用太阳能分解水制取H2:2H2O 2H2↑+ O2↑
2H2↑+ O2↑
(3)在2L的密闭容器中充入1molCO和2molH2,一定条件下发生反应:CO(g)+2H2(g) CH3OH(g),测得CO和CH3OH(g)浓度变化如下图所示。
CH3OH(g),测得CO和CH3OH(g)浓度变化如下图所示。

① 从反应开始到平衡,氢气的平均反应速率v(H2)=______ mol·L-1·min—1。反应前后容器的压强比为________ ,平衡时氢气的体积分数为_________ 。
② 能够判断该反应达到平衡的是_______ (填选项)。
A.CO、H2和CH3OH三种物质的浓度相等
B.密闭容器中混合气体的密度不再改变
C.CH3OH分解的速率和CH3OH生成的速率相等
D.相同时间内消耗1 mol CO,同时消耗1 mol CH3OH
(4)为使合成甲醇原料的原子利用率达100%,实际生产中制备水煤气时还使用CH4,则生产投料时,n(C)∶n(H2O)∶n(CH4)=__________ 。
(5)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用一个月才充电一次。假定放电过程中,甲醇完全氧化产生二氧化碳被充分吸收生成CO32-。写出该电池负极电极反应式__________________ ,正极电极反应式________________________ 。
(1)甲醇与乙醇互为
(2)工业上还可以通过下列途径获得H2,其中节能效果最好的是
A. 高温分解水制取H2:2H2O
 2H2↑+ O2↑
2H2↑+ O2↑B. 电解水制取H2:2H2O
 2H2↑+ O2↑
2H2↑+ O2↑C. 甲烷与水反应制取H2:CH4 + H2O
 3H2 + CO
3H2 + COD. 在光催化剂作用下,利用太阳能分解水制取H2:2H2O
 2H2↑+ O2↑
2H2↑+ O2↑(3)在2L的密闭容器中充入1molCO和2molH2,一定条件下发生反应:CO(g)+2H2(g)
 CH3OH(g),测得CO和CH3OH(g)浓度变化如下图所示。
CH3OH(g),测得CO和CH3OH(g)浓度变化如下图所示。
① 从反应开始到平衡,氢气的平均反应速率v(H2)=
② 能够判断该反应达到平衡的是
A.CO、H2和CH3OH三种物质的浓度相等
B.密闭容器中混合气体的密度不再改变
C.CH3OH分解的速率和CH3OH生成的速率相等
D.相同时间内消耗1 mol CO,同时消耗1 mol CH3OH
(4)为使合成甲醇原料的原子利用率达100%,实际生产中制备水煤气时还使用CH4,则生产投料时,n(C)∶n(H2O)∶n(CH4)=
(5)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用一个月才充电一次。假定放电过程中,甲醇完全氧化产生二氧化碳被充分吸收生成CO32-。写出该电池负极电极反应式
您最近一年使用:0次
10 . 如图为甲醇燃料电池的工作原理示意图,下列有关说法正确的是( )


| A.该燃料电池工作过程中电流方向从a极流向b极 |
| B.该燃料电池工作时电路中通过1 mol电子时,消耗的O2的体积为5.6 L |
| C.Pt(a)电极的反应式为CH3OH-6e-+H2O=CO2↑+6H+ |
| D.该燃料电池工作时H+由b极室向a极室移动,电解质溶液的pH增大 |
您最近一年使用:0次
2018-03-12更新
|
432次组卷
|
2卷引用:甘肃省兰州市2018届高三一诊理综化学试题



