名校
解题方法
1 . 下列选项描述与对应图像相符的是
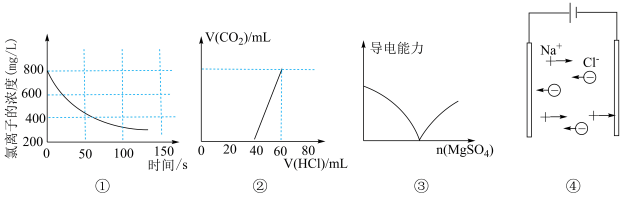

A.图①为新制氯水在阳光直射时,溶液中 浓度随着时间变化的曲线 浓度随着时间变化的曲线 |
B.图②为 、 、 混合液中滴加盐酸产生 混合液中滴加盐酸产生 的图像 的图像 |
C.图③为 溶液中滴加 溶液中滴加 溶液的导电性变化图像 溶液的导电性变化图像 |
D.图④为 在水溶液中电离的图示 在水溶液中电离的图示 |
您最近半年使用:0次
名校
2 . 十九大报告中提出要“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是
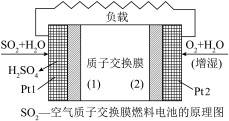

| A.该电池放电时质子从Pt2电极经过内电路流到Pt1电极 |
B.Pt1电极附近发生的反应为:SO2+2H2O+2e-= +4H+ +4H+ |
| C.Pt2电极附近发生的反应为O2+4e-+2H2O=4OH- |
| D.相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1 |
您最近半年使用:0次
名校
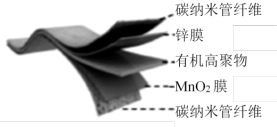
3 . 某可折叠的柔性电池的结构如下图,其放电总反应式为
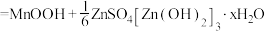 。有关该电池的说法正确的是
。有关该电池的说法正确的是

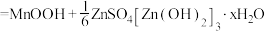 。有关该电池的说法正确的是
。有关该电池的说法正确的是
| A.给该电池充电时,将锌膜这一极接电源的正极 |
B.放电时,电子从Zn膜出发经有机高聚物到 膜 膜 |
C.充电时,阴极电极反应式: |
D.放电时,外电路中每通过2mol电子, 膜质量就会增加2g 膜质量就会增加2g |
您最近半年使用:0次
2022-05-20更新
|
245次组卷
|
4卷引用:吉林省长春市十一高中2021-2022学年高一下学期第二学程考试化学试题
吉林省长春市十一高中2021-2022学年高一下学期第二学程考试化学试题重庆市普通高中2022届高三学业水平选择性考试联合诊断化学试题(已下线)专题08 电化学及其应用-2022年高考真题模拟题分项汇编山东省青岛超银高级中学2023-2024学年高二下学期期初考试化学试卷
名校
4 . (1)生活中常见的碱性锌锰电池,总反应方程式为Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH),负极反应为:_______ 。
(2)废旧的锌锰电池还含有锌和二氧化锰等物质,用稀硫酸将其溶解,转化为硫酸锌和硫酸锰,其反应的化学方程式为:Zn+MnO2+2H2SO4=ZnSO4+MnSO4+2H2O。再进行电解可以得到锌和二氧化锰。电解装置如下:
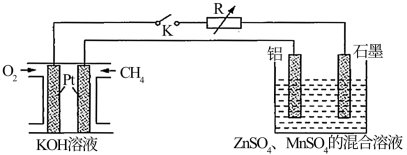
图中甲烷燃料电池负极的电极反应为_______ 。闭合开关K一段时间后,阳极附近溶液的pH_______ (填“增大”“不变”或“减小”),电解池中回收锌与MnO2的总反应离子方程式为_______ 。
(3)上述反应得到的二氧化锰可以用来制作新型的锰氢二次电池,原理示意图如图所示。
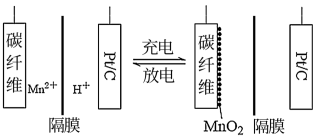
该电池以硫酸锰和硫酸的混合溶液为电解液,碳纤维和Pt/C分别作为电极材料,电池总反应式为:Mn2++2H2O MnO2+2H++H2↑。下列说法正确的是
MnO2+2H++H2↑。下列说法正确的是_______ 。
A.放电时,Pt/C电极为正极
B.放电时,电流由Pt/C电极流向碳纤维电极
C.充电时,阴极反应式为2H++2e-=H2↑
D.硫酸锰是丰富廉价工业盐,该电池成本低
(2)废旧的锌锰电池还含有锌和二氧化锰等物质,用稀硫酸将其溶解,转化为硫酸锌和硫酸锰,其反应的化学方程式为:Zn+MnO2+2H2SO4=ZnSO4+MnSO4+2H2O。再进行电解可以得到锌和二氧化锰。电解装置如下:

图中甲烷燃料电池负极的电极反应为
(3)上述反应得到的二氧化锰可以用来制作新型的锰氢二次电池,原理示意图如图所示。

该电池以硫酸锰和硫酸的混合溶液为电解液,碳纤维和Pt/C分别作为电极材料,电池总反应式为:Mn2++2H2O
 MnO2+2H++H2↑。下列说法正确的是
MnO2+2H++H2↑。下列说法正确的是A.放电时,Pt/C电极为正极
B.放电时,电流由Pt/C电极流向碳纤维电极
C.充电时,阴极反应式为2H++2e-=H2↑
D.硫酸锰是丰富廉价工业盐,该电池成本低
您最近半年使用:0次
名校
解题方法
5 . 如图所示的装置,电源为Zn-MnO2干电池,其电解质溶液是ZnCl2-NH4Cl混合溶液。X、Y都是惰性电极。将电源接通后,向甲中滴入酚酞溶液,在Fe极附近显红色。试回答下列问题:
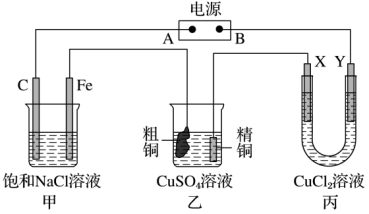
(1)在电源中,B电极为___________ 极(填“正极”或“负极”);该极的电极反应是___________ 。
(2)甲装置中总的化学方程式是___________ 。
(3)丙装置中Y电极为___________ 极(填“阴极”或“阳极”);通电一段时间后,X电极上发生的电极反应式是___________ 。
(4)如果乙装置中精铜电极的质量增加了0.64g,请问甲装置中,铁电极上产生的气体在标准状况下为___________ L。

(1)在电源中,B电极为
(2)甲装置中总的化学方程式是
(3)丙装置中Y电极为
(4)如果乙装置中精铜电极的质量增加了0.64g,请问甲装置中,铁电极上产生的气体在标准状况下为
您最近半年使用:0次
名校
6 . 下图是一个电化学过程的示意图。请回答下列问题:
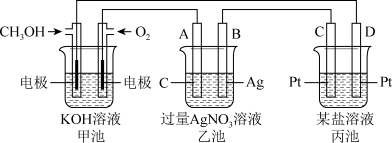
(1)图中甲池中OH−移向_________ 极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式:___________________
(3)A电极的名称是_____ , 乙池中反应的化学方程式_____________ 。
(4)当乙池中B(Ag)极质量增加10.8 g,甲池中理论上消耗O2的体积为________ L(标准状况),此时丙池中某电极析出某金属,则丙池中的某盐溶液可能是____________
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3

(1)图中甲池中OH−移向
(2)写出通入CH3OH的电极的电极反应式:
(3)A电极的名称是
(4)当乙池中B(Ag)极质量增加10.8 g,甲池中理论上消耗O2的体积为
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
您最近半年使用:0次
2020-10-26更新
|
578次组卷
|
2卷引用:辽源市第五中学2019-2020学年高一下学期第二次月考化学试题
名校
解题方法
7 . 利用如图装置,完成很多电化学实验.下列有关此装置的叙述中,不正确的是


| A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极保护法 |
| B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可加快铁的腐蚀 |
| C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子会向铜电极移动 |
| D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将减小 |
您最近半年使用:0次
2020-10-14更新
|
297次组卷
|
20卷引用:吉林省长春实验中学2019-2020学年高一6月月考化学试题
吉林省长春实验中学2019-2020学年高一6月月考化学试题2014-2015学年重庆市巫山中学高一下学期期末考试化学试卷(已下线)2013-2014学年甘肃省兰州一中高二上学期期末考试化学试卷2015-2016学年湖北省宜昌一中高二下2月月考化学试卷2016-2017学年山东省济南市长清一中高二上第一次质检化学卷2017届湖南省衡阳市第八中学高三上质检二化学卷2017届湖南省衡阳市第八中学高三第二次质检化学试卷河北省邯郸市成安县第一中学2017-2018学年高二9月月考化学试题安徽省滁州市定远县西片三校2017-2018学年高二上学期期末考试化学试题江西省师范大学附属中学2019届高三上学期期末考试化学试题(已下线)第01章 化学反应与能量转化(B卷能力提升篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材鲁科版)山东省滕州市第一中2020-2021学年高二上学期10月月考化学试题山东省新泰一中东校2020-2021学年高二上学期第一次月考化学试题山东省济南市山东师范大学附属中学2020-2021学年高二上学期10月学业质量检测化学试题山东省德州市10校联考2020—2021学年高二上学期期中模块检测(人教版) 化学试题(已下线)第四章 电化学基础(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版选修4)黑龙江省大庆市大庆实验中学2020-2021学年高二下学期开学考试化学试题山东省德州市夏津第一中学2021-2022学年高二上学期第一次月考化学试卷(已下线)第29讲 第四章《化学反应与电能》单元测试(培优提升)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)四川省成都市第七中学2022-2023学年高二下学期3月月考化学试题
名校
8 . 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的 溶液、
溶液、 溶液、x溶液,a、b、c、d电极均为石墨电极,接通电源经过一段时间后,乙中c电极质量增加,据此回答问题:
溶液、x溶液,a、b、c、d电极均为石墨电极,接通电源经过一段时间后,乙中c电极质量增加,据此回答问题:
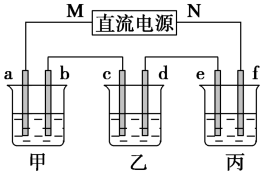
(1)电源的M端为___________ 极;(填名称)
(2)电极d上发生的电极反应式为___________ ,乙池溶液
___________ (填“增大”、“减小”或“不变”)
(3)甲池中的总反应式为__________ ;
(4)当电路中有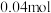 电子通过时,a、b、c、d电极上产生的气体或固体的物质的量之比是
电子通过时,a、b、c、d电极上产生的气体或固体的物质的量之比是___________ ;
(5)若利用丙池实现铁上镀铜,则e、f、x依次是___________ (填化学式);若利用丙池实现电解精炼铜,则f电极材料是___________ (填具体物质);
(6)实验测得, 甲醇
甲醇 液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出
液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出 的热量,则表示甲醇燃烧热的热化学方程式为:
的热量,则表示甲醇燃烧热的热化学方程式为:__________
 溶液、
溶液、 溶液、x溶液,a、b、c、d电极均为石墨电极,接通电源经过一段时间后,乙中c电极质量增加,据此回答问题:
溶液、x溶液,a、b、c、d电极均为石墨电极,接通电源经过一段时间后,乙中c电极质量增加,据此回答问题:
(1)电源的M端为
(2)电极d上发生的电极反应式为

(3)甲池中的总反应式为
(4)当电路中有
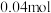 电子通过时,a、b、c、d电极上产生的气体或固体的物质的量之比是
电子通过时,a、b、c、d电极上产生的气体或固体的物质的量之比是(5)若利用丙池实现铁上镀铜,则e、f、x依次是
(6)实验测得,
 甲醇
甲醇 液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出
液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出 的热量,则表示甲醇燃烧热的热化学方程式为:
的热量,则表示甲醇燃烧热的热化学方程式为:
您最近半年使用:0次
2020-08-30更新
|
95次组卷
|
2卷引用:吉林省长春实验中学2019-2020学年高一6月月考化学试题
名校
解题方法
9 . 图是一个化学过程的示意图,三个烧杯中溶液的体积均为200mL。
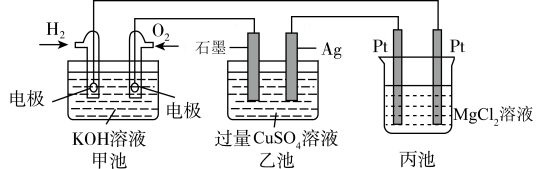
(1)图中甲池是__________________ 装置(填“原电池”或“电解池”)。
(2)通入O2的电极名称是___________ ,石墨电极的名称是___________ 。
(3)写出电极反应式:通入H2的电极的电极反应式是_______ Ag电极的电极反应式为______________ 。
(4)丙池中反应的化学方程式为____________________________ 。
(5)当甲池中消耗112mL(标准状况下)O2时,乙池中溶液的氢离子浓度约为____ (假设溶液体积不变);反应后可向溶液中加入适量的_______ 能复原溶液。

(1)图中甲池是
(2)通入O2的电极名称是
(3)写出电极反应式:通入H2的电极的电极反应式是
(4)丙池中反应的化学方程式为
(5)当甲池中消耗112mL(标准状况下)O2时,乙池中溶液的氢离子浓度约为
您最近半年使用:0次
名校
10 . 如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
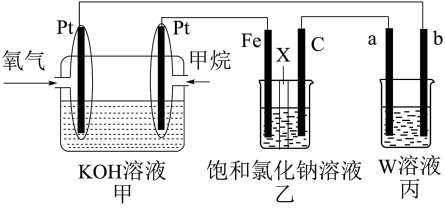
(1)石墨电极(C)作_________ 极,若丙池中W为Na2SO4溶液并滴有酚酞,实验开始后观察到的现象是________ 甲中甲烷燃料电池的负极反应式为___________________________ 。
(2)若消耗2.24 L(标况)氧气,则乙装置中铁电极上生成的气体体积(标况)为_________ L。
(3)若丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是__________________ 。
A.b电极为粗铜 B.粗铜接电源正极,发生还原反应
C.CuSO4溶液的浓度保持不变 D.利用阳极泥可回收Ag、Pt、Au等金属
(4)假设乙装置中氯化钠溶液足够多,若在标准状况下,有224 mL氧气参加反应,则乙装置中阳离子交换膜,左侧溶液质量将__________________ ,(填“增大”“减小”或“不变”),且变化了__________________ 克。

(1)石墨电极(C)作
(2)若消耗2.24 L(标况)氧气,则乙装置中铁电极上生成的气体体积(标况)为
(3)若丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
A.b电极为粗铜 B.粗铜接电源正极,发生还原反应
C.CuSO4溶液的浓度保持不变 D.利用阳极泥可回收Ag、Pt、Au等金属
(4)假设乙装置中氯化钠溶液足够多,若在标准状况下,有224 mL氧气参加反应,则乙装置中阳离子交换膜,左侧溶液质量将
您最近半年使用:0次



