13-14高三·全国·课后作业
名校
解题方法
1 . 已知铅酸蓄电池的工作原理为Pb+PbO2+2H2SO4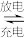 2PbSO4+2H2O。现用如图装置进行电解实验,测得当铅酸蓄电池中转移0.4mol电子时,铁电极的质量减少11.2g。请回答下列问题:
2PbSO4+2H2O。现用如图装置进行电解实验,测得当铅酸蓄电池中转移0.4mol电子时,铁电极的质量减少11.2g。请回答下列问题:___ 极,铅酸蓄电池正极的电极反应式为__ ,放电过程中电解液的密度(忽略电解液的体积变化)__ (填“减小”“增大”或“不变”)。
(2)Ag电极的电极反应式是__ ,该电极的电极产物有__ g。
(3)Cu电极的电极反应式是__ ,CuSO4溶液的浓度__ (填“减小”“增大”或“不变”)。
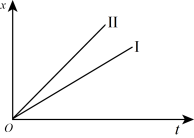
(4)如图表示电解进行过程中某个物理量x随时间t的变化曲线,其中曲线Ⅰ表示左侧U形管中的变化,曲线Ⅱ表示右侧U形管中的变化,则x表示__ (填序号)。
b.U形管中阳极质量的减少量
c.U形管中阴极质量的增加量
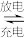 2PbSO4+2H2O。现用如图装置进行电解实验,测得当铅酸蓄电池中转移0.4mol电子时,铁电极的质量减少11.2g。请回答下列问题:
2PbSO4+2H2O。现用如图装置进行电解实验,测得当铅酸蓄电池中转移0.4mol电子时,铁电极的质量减少11.2g。请回答下列问题:
(2)Ag电极的电极反应式是
(3)Cu电极的电极反应式是
(4)如图表示电解进行过程中某个物理量x随时间t的变化曲线,其中曲线Ⅰ表示左侧U形管中的变化,曲线Ⅱ表示右侧U形管中的变化,则x表示
b.U形管中阳极质量的减少量
c.U形管中阴极质量的增加量
您最近一年使用:0次
2020-10-13更新
|
239次组卷
|
11卷引用:宁夏银川市六盘山高级中学2017-2018学年高二上学期第一次月考化学试题
宁夏银川市六盘山高级中学2017-2018学年高二上学期第一次月考化学试题2015-2016学年内蒙古奋斗中学高二上9月质检化学试卷2015-2016学年河南省南阳部分高中高二上学期第一次联考化学试卷河南省郑州市中牟县二中2017-2018学年高二第一次月考化学试题山东省济宁市实验中学2018-2019学年高二上学期第二次月考化学试题人教版(2019)高二化学选择性必修1第四章 化学反应与电能 第二节 电解池 课时2 电解原理的应用(已下线)2014年化学高考总复习课时演练9-2电解池金属电化学腐蚀与防护练习卷贵州省余庆中学2019-2020学年上学期开学考试高三化学试题贵州省荔波高级中学2019-2020学年高三上学期期末考试理综化学试题贵州省施秉县一中2019-2020学年高三上学期期末考试化学试题贵州省望黔西南布依族苗族自治州谟民族中学2019-2020学年高三上学期期末考试化学试题
2011·广东·三模
名校
2 . 关于下列各装置图的叙述不正确的是
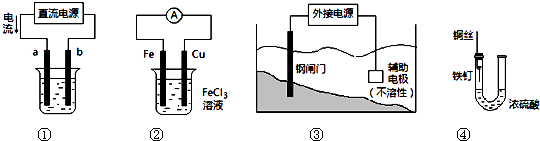

| A.用装置①精炼铜,则b极为精铜,电解质溶液为CuSO4溶液 |
| B.装置②的总反应是Cu+2Fe3+==Cu2++2Fe2+ |
| C.装置③中钢闸门应与外接电源的负极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
您最近一年使用:0次
2020-08-29更新
|
998次组卷
|
57卷引用:2013-2014宁夏银川一中下学期期中考试高二化学试卷
(已下线)2013-2014宁夏银川一中下学期期中考试高二化学试卷宁夏回族自治区银川一中2022-2023学年高二上学期期末考试化学试题(已下线)2011-2012学年福建师大附中高二上学期期末考试化学试卷(已下线)2011-2012学年福建省南安市侨光中学高二上学期期末考试化学试卷(已下线)2013-2014学年江苏省淮安市高中协作体高二下学期期中考试化学试卷(已下线)2013-2014学年内蒙古包头一中高二下学期期末考试化学试卷2014-2015河南省濮阳市一中高二上学期第三次质量检测化学试卷2014-2015甘肃省白银市会宁县五中高二上学期期末化学试卷2014-2015河南省濮阳市一中高二上学期第三次月考化学试卷2015-2016学年河北省邢台一中高二上第一次月考化学试卷2015-2016学年山西省怀仁一中高二下第一次月考化学试卷2016-2017学年河北省定兴三中高二上学期第一次月考化学试卷2016-2017学年广东省湛江一中高二上第一次大考化学卷2016-2017学年山东省济南市长清一中高二上第一次质检化学卷安徽省黄山市2016-2017学年高二上学期期末质量检测化学试题山东省新泰二中、泰安三中、宁阳二中2017-2018学年高二上学期期中联考化学试卷黑龙江省牡丹江市第一高级中学2017-2018学年高二上学期期中考试化学(理)试题黑龙江省大庆中学2017-2018学年高二上学期期末考试化学试题【全国百强校】内蒙古第一机械制造(集团)有限公司第一中学2018-2019学年高二上学期期中考试化学试题【全国百强校】河北省石家庄市第一中学2018-2019学年高二上学期期中考试化学试题黑龙江省牡丹江市第三高级中学2018-2019学年高二上学期期中考试化学试题【全国百强校】浙江省台州中学2018-2019学年高二上学期第二次统练化学试题甘肃省临夏市临夏中学2018-2019学年高二下学期第一次月考化学试题浙江省杭州市西湖高级中学2018-2019学年高二4月月考化学试题北京十二中2018-2019学年第二学期高二年级6月月考试题山东省德州市夏津第一中学2019-2020学年高二上学期第一次月考化学试题浙江省嘉兴市第一中学2019-2020学年高二10月月考化学试题(已下线)【新东方】高中化学5016福建省莆田第七中学2019-2020学年高二上学期期中复习检测化学试题2陕西省渭南韩城市2019-2020学年高二上学期期中考试化学试题黑龙江省牡丹江市第三高级中学2019-2020学年高二上学期期末考试化学试题(已下线)【新东方】2020-4新疆昌吉回族自治州第二中学2019-2020学年高二下学期期中考试化学试题河北省邢台市第二中学2019-2020学年高二上学期期中考试化学试题重庆市第一中学2019-2020学年高二下学期期末考试化学试题四川省绵阳南山中学2019-2020学年高二下学期6月月考化学试题山东省济南市山东师范大学附属中学2020-2021学年高二上学期10月学业质量检测化学试题浙江省宁波诺丁汉大学附属中学2020-2021学年高二上学期10月月考化学试题广东省珠海市第二中学2019-2020学年高二上学期期中考试化学试题河北省保定市唐县第一中学20202-2021学年高二上学期第二次月考化学试卷题河南省南乐县第一高级中学2021-2022学年高二下学期3月月考化学试题甘肃省武威第七中学2021-2022学年高二下学期学科竞赛化学试题(已下线)2011届广东省六校高三下学期第三次模拟考试(理综)化学部分(已下线)2012届北京市101中学高三上学期统考二化学试卷2015届重庆市七校高三上学期期末联考理综化学试卷 2015届广东省珠海市高三下学期二模理综化学试卷2016届甘肃省嘉峪关一中高三上第三次模拟考试化学试卷2016届福建省连江县尚德中学高三上学期12月月考化学试卷高中化学人教版 选修四 第四章 电化学基础 第四节 金属的电化学腐蚀与防护 金属的电化学腐蚀与防护【全国百强校】青海省西宁市第四高级中学2019届高三上学期第四次模拟考试理科综合化学试题福建省泉州市泉港区第一中学2019届高三上学期第二次月考化学试题2020届高三化学知识点强化训练----化学能与电能浙江省瑞安市上海新纪元高级中学2019-2020学年高一下学期期末考试化学试题(1)辽宁师范大学附属中学2018-2019学年高一下学期期末考试化学试题(已下线)山东省济南外国语学校2019届高三12月月考化学试题(答案不全)重庆市缙云教育联盟2020-2021学年高一上学期10月月考化学试题(已下线)第六章能力提升检测卷-2021年高考化学一轮复习讲练测
名校
解题方法
3 . 如图所示的装置,C、D、E、F是惰性电极。甲中是硫酸铜溶液、乙中是饱和氯化钠溶液,将电源接通后,在F极附近能产生使湿润淀粉-KI试纸变蓝的气体。则以下说法正确的是
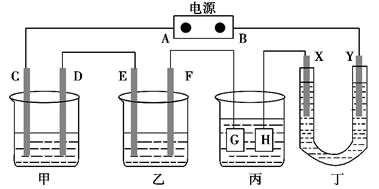
| A.A极是电源正极 |
| B.丙装置给锌镀银,G应该是Ag,电镀液是AgNO3溶液 |
| C.甲、乙装置的D、E电极均有单质生成,其物质的量之比为1:2 |
| D.装置丁的X极是铁,电解液是硫酸钠溶液,丁中可得到白色的Fe(OH)2沉淀 |
您最近一年使用:0次
2020-08-05更新
|
270次组卷
|
2卷引用:宁夏回族自治区吴忠市滨河中学2023-2024学年高二下学期期末考试化学试题
名校
解题方法
4 . 某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。请回答下列问题:
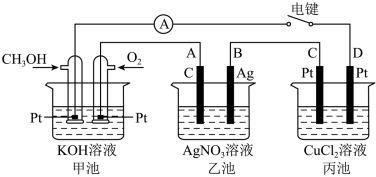
(1)甲池中O2的电极反应式为________________ ;CH3OH的电极反应式为_______________ ;
(2)当乙池中B极质量增加10.8g时,甲池中理论上消耗O2的体积为____________ mL(标准状况下),丙池总反应方程式__________________ ;
(3)若丙中电极不变,将其溶液换成CuSO4溶液,电键闭合一段时间后,甲中溶液的pH将____________ (填“增大”“减小”或“不变”);丙中溶液的pH将______________ (填“增大”“减小”或“不变”)。
(4)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:2PbSO4+2H2O Pb+PbO2+2H2SO4,铅蓄电池放电时,
Pb+PbO2+2H2SO4,铅蓄电池放电时,______________ (填物质化学式)在负极发生反应。若电解液体积为2 L(反应过程溶液体积变化忽略不计),放电过程中外电路中转移4 mol电子,则硫酸浓度由5 mol/L下降到_____________ mol/L。

(1)甲池中O2的电极反应式为
(2)当乙池中B极质量增加10.8g时,甲池中理论上消耗O2的体积为
(3)若丙中电极不变,将其溶液换成CuSO4溶液,电键闭合一段时间后,甲中溶液的pH将
(4)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:2PbSO4+2H2O
 Pb+PbO2+2H2SO4,铅蓄电池放电时,
Pb+PbO2+2H2SO4,铅蓄电池放电时,
您最近一年使用:0次
2020-08-05更新
|
178次组卷
|
2卷引用:宁夏吴忠中学2020-2021学年高二10月月考理综化学试题
名校
解题方法
5 . 镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O  Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是
 Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是| A.放电时负极得电子,质量减轻 |
| B.放电时负极附近的pH增大 |
| C.充电时该电池的正极与外加电源的负极相连 |
| D.充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O |
您最近一年使用:0次
2020-07-14更新
|
145次组卷
|
2卷引用:宁夏回族自治区石嘴山市第三中学2019-2020学年高二下学期期末考试化学试题
名校
解题方法
6 . 下列为四个常用的电化学装置,关于它们的叙述正确的是


| A.图(a)中,MnO2的作用是催化剂 |
| B.图(b)所示电池放电过程中,两极板的质量不断增大 |
| C.图(c)所示装置工作过程中,电解质溶液中Cu2+浓度始终不变 |
| D.图(d)所示电池充电过程中,Ag2O是氧化剂,电池工作过程中还原为Ag |
您最近一年使用:0次
2020-07-12更新
|
365次组卷
|
22卷引用:宁夏石嘴山市第三中学2016-2017学年高二下学期期中考试化学试题
宁夏石嘴山市第三中学2016-2017学年高二下学期期中考试化学试题2015-2016学年黑龙江哈尔滨六中高二下期末化学试卷2016-2017学年河北省邯郸市第一中学高二下学期开学考试化学试卷陕西省西安市高新一中2016-2017学年高二上学期第一次月考化学试题(已下线)2017-2018学年上学期期末复习备考之精准复习模拟题高二化学选修4(B卷)【全国百强校】河南省南阳市第一中学2018-2019学年高二下学期第四次月考化学试题新疆自治区生产建设兵团第二中学2018-2019学年高二第一次月考化学试题山西省朔州市怀仁一中2019-2020学年高二上学期第四次月考化学试题江苏省华东师范大学盐城实验中学2021-2022学年高二上学期第一次月考化学试题 江苏省连云港高级中学2022-2023高二上学期第一次阶段测试化学试题福建省福州市闽侯县第一中学2023-2024学年高二上学期10月月考化学试题江苏省盐城市大丰区新丰中学2023-2024学年高二上学期第二次学情调研化学试题(选修)2017届山东省高密市高三上学期10月统考化学试卷黑龙江省大庆实验中学2018届高三上学期期初考试化学试题黑龙江省大庆实验中学2018届高三上学期开学考试化学试题天津市耀华中学2018届高三上学期第一次月考化学试题河北省衡水市安平中学2018届高三上学期期中考试化学试题【全国校级联考】辽宁省抚顺市六校2017-2018学年高一下学期期末考试化学试题2020届二轮复习 电化学 专题卷(全国通用)2019年秋高三化学复习强化练习—— 化学能与电能浙江省温州市平阳县2020届高三高考适应性考试(6月)化学试题(已下线)第六章能力提升检测卷(精练)-2022年高考化学一轮复习讲练测
名校
解题方法
7 . 某二次电池充、放电的化学方程式为:2K2S2+KI3 K2S4+3KI,与其它设备连接的电路如图示。当闭合开关K时,X附近溶液先变红.则下列说法正确的是
K2S4+3KI,与其它设备连接的电路如图示。当闭合开关K时,X附近溶液先变红.则下列说法正确的是
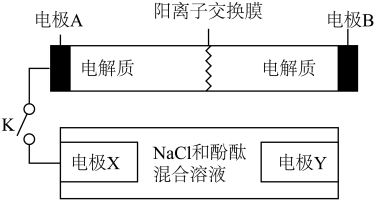
 K2S4+3KI,与其它设备连接的电路如图示。当闭合开关K时,X附近溶液先变红.则下列说法正确的是
K2S4+3KI,与其它设备连接的电路如图示。当闭合开关K时,X附近溶液先变红.则下列说法正确的是
| A.K+从右到左通过阳离子交换膜 |
| B.A的电极反应式为:3I﹣﹣2e﹣=I3﹣ |
| C.当有0.1molK+通过离子交换膜,X电极上产生标准状况的气体1.12L |
| D.电池充电时,B电极要与外电源的正极相连,电极上发生还原反应 |
您最近一年使用:0次
2020-05-28更新
|
101次组卷
|
4卷引用:宁夏银川一中2021-2022学年高二上学期期末考试化学试题
12-13高三下·北京海淀·期末
名校
8 . 有关下列四个常用电化学装置的叙述中,正确的是( )
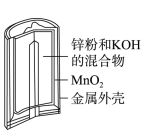 | 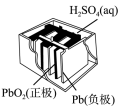 |  | 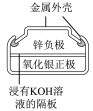 |
| 图Ⅰ 碱性锌锰电池 | 图Ⅱ 铅硫酸蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌纽扣电池 |
| A.图Ⅰ所示电池中,MnO2的作用是催化剂 |
| B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大 |
| C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变 |
| D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag |
您最近一年使用:0次
2020-05-23更新
|
264次组卷
|
13卷引用:宁夏育才中学2019-2020学年高二上学期期末考试化学试题
宁夏育才中学2019-2020学年高二上学期期末考试化学试题北京师范大学附属中学2017-2018学年高二上学期期末考试化学试题新疆生产建设兵团第二中学2017-2018学年高二上学期第四次月考(期末)化学试题吉林省九台市第四中学2017-2018学年高二上学期期末考试化学试题【校级联考】湖南省浏阳一中、醴陵一中2018-2019学年高二上学期12月联考化学试题【校级联考】江西省南昌市八一中学、洪都中学等七校2018-2019学年高二上学期期末考试化学试题黑龙江省牡丹江市穆棱市第一中学2019-2020学年高二上学期期末考试化学试题福建省三明第一中学2021-2022学年高二上学期开学考试化学试题江西省南昌市八一中学、洪都中学、南师附中、十七中四校2021-2022学年高二上学期期末联考化学考试试题(已下线)2013届北京市海淀区高三下学期期末练习理综化学试卷新疆克拉玛依市2018届高三第三次模拟检测理综化学试题辽源市第五中学2019-2020学年高一下学期第二次月考化学试题江西省赣州市石城中学2022-2023学年高一下学期第一次月考化学试题
名校
解题方法
9 . 某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理。

根据要求回答相关问题:
(1)甲装置中,通入氢气的电极为_______ (填“正极”或“负极”),该极电极反应式为_______ ;若将KOH溶液换成硫酸溶液,则正极电极反应式为_______ 。
(2)关于乙装置,下列说法正确的是_______ (填序号);
①溶液中Na+向C极移动
②从C极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后通入适量HCl可恢复到电解前电解质的浓度
④若标准状况下Fe极产生2.24L气体,则溶液中转移0.2mol电子
该装置中发生的总反应的离子方程式为_______ 。
(3)乙装置中,X为阳离子交换膜,反应一段时间后交换膜左侧溶液中pH_______ (填“增大”、“减小”或“不变”);若用饱和MgCl2溶液代替饱和氯化钠溶液,则该装置中发生的总反应_______ (填“改变”或“不变”)。
(4)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将_______ (填“增大”“减小”或“不变”),精铜电极上的电极反应式为_______ 。

根据要求回答相关问题:
(1)甲装置中,通入氢气的电极为
(2)关于乙装置,下列说法正确的是
①溶液中Na+向C极移动
②从C极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后通入适量HCl可恢复到电解前电解质的浓度
④若标准状况下Fe极产生2.24L气体,则溶液中转移0.2mol电子
该装置中发生的总反应的离子方程式为
(3)乙装置中,X为阳离子交换膜,反应一段时间后交换膜左侧溶液中pH
(4)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将
您最近一年使用:0次
2020-05-18更新
|
93次组卷
|
2卷引用:宁夏自治区银川市北方民族大学附属中学2019-2020学年度(下)高二月考试卷
名校
10 . 铅蓄电池的工作原理为Pb+PbO2+2H2SO4=2PbSO4+2H2O,研读如图,下列判断正确的是( )
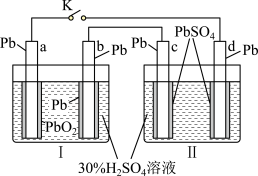

| A.K闭合时,d电极的电极反应式:PbSO4+2e-=Pb+ SO42- |
| B.当电路中通过0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol |
| C.K闭合时,Ⅱ中SO42-向c电极迁移 |
| D.K闭合一段时间后,Ⅱ可单独作为原电池,d电极为负极 |
您最近一年使用:0次
2020-05-16更新
|
237次组卷
|
2卷引用:宁夏石嘴山市第三中学2019-2020学年高二下学期期中考试化学试题



