名校
1 . 甲、乙两电池电极材料都是铁棒与碳棒,请回答下列问题:
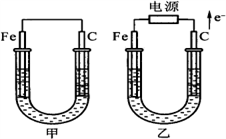
(1)若两电池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________ 棒,乙池中的________ 棒.(填“Fe”或“C”)
②乙池中的阳极反应式为:________________ .
③乙池中总反应的化学方程式为:________________ .
(2)若两池中均为饱和NaCl溶液,溶液中滴两滴酚酞.
①乙池中总的离子方程式为:________________ .
②甲池C极上的电极反应式为:________________ .
③甲池中首先出现红色的是_____ 极;乙池中首先出现红色的是______ 极(填“Fe”或“C”)

(1)若两电池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的
②乙池中的阳极反应式为:
③乙池中总反应的化学方程式为:
(2)若两池中均为饱和NaCl溶液,溶液中滴两滴酚酞.
①乙池中总的离子方程式为:
②甲池C极上的电极反应式为:
③甲池中首先出现红色的是
您最近一年使用:0次
名校
2 . 一种锂铜可充电电池,工作原理如图所示。在该电池中,非水系电解液和水系电解液被锂离子固体电解质陶瓷片(LISICON) 隔开。下列说法不正确的是
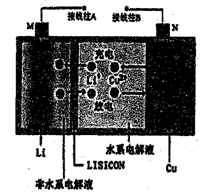

| A.充电时,接线柱A应与外接电源的正极相违 |
| B.放电时,N为电池的正极 |
| C.充电时,阴极反应为: Li++e-=Li |
| D.陶瓷片允许Li+通过,不允许水分子通过 |
您最近一年使用:0次
2018-05-05更新
|
181次组卷
|
6卷引用:新疆乌鲁木齐地区2018届高三第一次诊断测试化学试题
新疆乌鲁木齐地区2018届高三第一次诊断测试化学试题福建省厦门双十中学2017-2018学年高二下学期期中考试化学试题【全国百强校】福建省泉州第五中学2017届高三上学期期中检测化学试题(已下线)【全国百强校】北京市第四中学2018-2019学年高二上学期期中考试化学试题宁夏石嘴山市第三中学2020届高三第五次模拟考试理综化学试题江西省南昌市新建区第二中学2021届高三上学期12月月考化学试题
3 . 一种碳纳米管能够吸附氢气,可作充电电池( 如图所示)的碳电极,该电池的电解质溶液为6 mol/L KOH溶液,下列说法中正确的是


| A.放电时镍电极反应为:NiOOH +H2O +e-=Ni(OH)2 +OH- |
| B.放电时碳电极反应为:2H+ +2e-= H2 ↑ |
| C.充电时将碳电极与电源的正极相连 |
| D.充电时阴极发生氧化反应 |
您最近一年使用:0次
名校
4 . 银锌蓄电池应用广泛,放电时总反应为Zn+Ag2O2+H2O==Zn(OH)2+Ag2O,某小组以银锌蓄电池为电源,用惰性电极电解饱和Na2SO4溶液制备H2SO4和NaOH,设计如图所示装置。连通电路后,下列说法正确的是


| A.电池的a极反应式为Ag2O2+H2O+2e-=Ag2O+2OH- |
| B.气体Y为H2 |
| C.pq膜适宜选择阳离子交换膜 |
| D.电池中消耗65gZn,理论上生成1mol 气体X |
您最近一年使用:0次
2018-03-10更新
|
723次组卷
|
3卷引用:新疆维吾尔自治区第二师华山中学2018-2019学年高二上学期期中考试化学试题
名校
解题方法
5 . 某同学设计一个燃料电池(如下图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
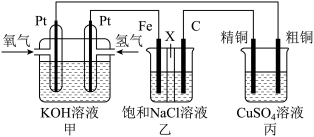
根据要求回答相关问题:
(1)通入氢气的电极为________ (填“正极”或“负极”),负极的电极反应式为__________ 。
(2)石墨电极为________ (填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,________ (填“铁极”或“石墨极”)区的溶液先变红。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将________ (填“增大”“减小”或“不变”)。精铜电极上的电极反应式为____________________ 。

根据要求回答相关问题:
(1)通入氢气的电极为
(2)石墨电极为
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将
您最近一年使用:0次
2017-12-18更新
|
158次组卷
|
5卷引用:新疆呼图壁县第一中学2021-2022学年高二上学期期中考试化学试题
解题方法
6 . 在原电池和电解池的电极上所发生反应的类型相同的是
| A.原电池的正极和电解池阳极 | B.电解池阳极和电解池阴极 |
| C.原电池负极和电解池阳极 | D.原电池的正极和原电池负极 |
您最近一年使用:0次
2017-05-04更新
|
277次组卷
|
2卷引用:新疆呼图壁县第一中学2021-2022学年高二上学期期中考试化学试题
7 . 碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS等)来制备,其工艺流程如下:
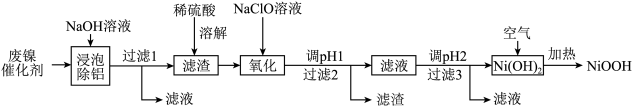
回答下列问题:
(1) “浸泡除铝”时,发生反应的化学方程式为___________ 。
(2) “溶解”时放出的气体为________ (填化学式)。硫酸镍溶液可用于制备合成氨的催化剂ConNi(1-n)Fe2O4。如图表示在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线,由图分析可知Co2+、Ni2+两种离子中催化效果更好的是________________ 。

(3)“氧化”时,酸性条件下,溶液中的Fe2+被氧化为Fe3+,其离子方程式为________ 。
(4)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
“调pH1”时,溶液pH范围为________ ;过滤2所得滤渣的成分________ (填化学式)。
(5)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式________________ 。
(6)含镍金属氢化物MH-Ni燃料电池是一种绿色环保电池,广泛应用于电动汽车。其中M代表储氢合金,MH代表金属氢化物,电解质溶液可以是KOH水溶液。它的充、放电反应为:xNi(OH)2+M MHx+xNiOOH;电池充电过程中阳极的电极反应式为
MHx+xNiOOH;电池充电过程中阳极的电极反应式为________ ;放电时负极的电极反应式为________ 。

回答下列问题:
(1) “浸泡除铝”时,发生反应的化学方程式为
(2) “溶解”时放出的气体为

(3)“氧化”时,酸性条件下,溶液中的Fe2+被氧化为Fe3+,其离子方程式为
(4)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH1”时,溶液pH范围为
(5)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式
(6)含镍金属氢化物MH-Ni燃料电池是一种绿色环保电池,广泛应用于电动汽车。其中M代表储氢合金,MH代表金属氢化物,电解质溶液可以是KOH水溶液。它的充、放电反应为:xNi(OH)2+M
 MHx+xNiOOH;电池充电过程中阳极的电极反应式为
MHx+xNiOOH;电池充电过程中阳极的电极反应式为
您最近一年使用:0次
2014·江苏徐州·三模
名校
8 . 高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为3Zn + 2K2FeO4 + 8H2O ═ 3Zn(OH)2 + 2Fe(OH)3 + 4KOH.下列叙述正确的是
| A.放电时,负极反应式为3Zn﹣6e﹣+6OH﹣═3Zn(OH)2 |
| B.放电时,正极区溶液的pH减小 |
| C.充电时,每转移3mol电子,阳极有1mol Fe(OH)3被还原 |
| D.充电时,电池的锌电极接电源的正极 |
您最近一年使用:0次
2016-12-09更新
|
322次组卷
|
13卷引用:2017届新疆哈密地区第二中学高三上月考二化学卷
2017届新疆哈密地区第二中学高三上月考二化学卷新疆巴州种畜场学校2019届高三下学期第二次模拟考试理科综合化学试题(已下线)2013-2014江苏省徐州市高三第三次模拟考试化学试卷2015届甘肃省天水市秦安二中高三上学期第四次检测化学试卷2014-2015河北省唐山市一中高二下学期开学调研化学试卷2016届四川省乐山市高中高三上学期第二次调研考试化学试卷2016届江西省宜春市丰城中学高三上学期第四次月考化学试卷2016-2017学年福建省龙岩四校高二上学期期中联考化学试卷福建省福州市八县(市)协作校2017-2018学年高二上学期期中联考化学(理)试题福建省清流一中2017-2018学年高二上学期第二阶段(期中)考试化学(理)试题福建省泉州第十六中学2019-2020学年高二上学期期中考试化学(选考班)试题福建省福州市八县(市)一中2020-2021学年高二上学期期中联考化学试题福建省安溪县2022-2023学年高二上学期11月期中考试化学试题
9 . 工业常用燃料与水蒸气反应制备H2和CO,再用H2和CO合成甲醇。
(1)制取H2和CO通常采用:C(s)+H2O(g)⇌CO(g)+H2(g)△H=+131.4kJ•mol-1,下列判断正确的是_______ 。
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g)⇌C(s)+H2O(1)△H=﹣QkJ•mol-1,则Q<131.4
d.若C(s)+CO2(g)⇌2CO(g)△H1;CO(g)+H2O(g)⇌H2(g)+CO2(g)△H2则:△H1+△H2=+131.4kJ•mol-1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g)⇌CO(g)+3H2(g)。已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如表:
根据表中数据计算:
①0min~2min 内H2的平均反应速率为_____________________ 。
②达平衡时,CH4的转化率为_____________ ;在上述平衡体系中再充入2.00mol甲烷1.00mol 水蒸气,达到新平衡时H2的体积分数与原平衡相比___________ (填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有__________ (填字母)。
a.CO的含量保持不变 b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变 d.3υ正(CH4)=υ逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的。工作原理如图( c为隔膜,甲醇不能通过,其它离子和水可以自由通过):
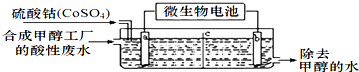
①a电极的名称为__________ 。
②写出除去甲醇的离子方程式______________________ 。
③微生物电池是绿色酸性燃料电池,写出该电池正极的电极反应式为__________________ 。
(1)制取H2和CO通常采用:C(s)+H2O(g)⇌CO(g)+H2(g)△H=+131.4kJ•mol-1,下列判断正确的是
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g)⇌C(s)+H2O(1)△H=﹣QkJ•mol-1,则Q<131.4
d.若C(s)+CO2(g)⇌2CO(g)△H1;CO(g)+H2O(g)⇌H2(g)+CO2(g)△H2则:△H1+△H2=+131.4kJ•mol-1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g)⇌CO(g)+3H2(g)。已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如表:
| 不同时间各物质的物质的量/mol | ||||
| 0min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |
根据表中数据计算:
①0min~2min 内H2的平均反应速率为
②达平衡时,CH4的转化率为
a.CO的含量保持不变 b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变 d.3υ正(CH4)=υ逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的。工作原理如图( c为隔膜,甲醇不能通过,其它离子和水可以自由通过):

①a电极的名称为
②写出除去甲醇的离子方程式
③微生物电池是绿色酸性燃料电池,写出该电池正极的电极反应式为
您最近一年使用:0次
2016-12-09更新
|
277次组卷
|
3卷引用:新疆阿瓦提县多浪乡中学2019届高三第三次模拟考试理科综合化学试题
名校
10 . 已知在一容器中发生反应:Fe+Cu2+=Fe2++Cu,有关说法正确的是
| A.可能为电解池反应,Fe做阴极,CuSO4溶液做电解液 |
| B.可能为原电池反应,负极Fe被还原为Fe2+ |
| C.可能为电解池反应,阳极反应:Fe-2e-=Fe2+ |
| D.可能为原电池反应,Fe做负极,Zn做正极,CuSO4溶液为电解液 |
您最近一年使用:0次
2016-12-09更新
|
160次组卷
|
5卷引用:新疆维吾尔自治区且末县第二中学2018-2019学年高二上学期期末考试化学试题



