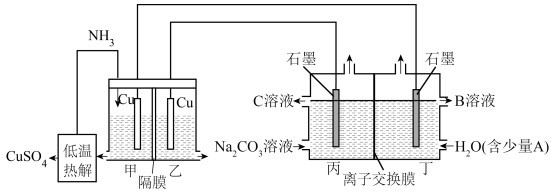
1 . 利用热再生氨电池可实现 电镀废液的浓缩再生,同时利用该电池电解
电镀废液的浓缩再生,同时利用该电池电解 溶液制取
溶液制取 溶液和
溶液和 溶液,装置如图所示,甲、乙两室均预加相同的
溶液,装置如图所示,甲、乙两室均预加相同的 电镀废液,向甲室通入足量氨气后电池开始工作。下列说法错误的是
电镀废液,向甲室通入足量氨气后电池开始工作。下列说法错误的是
 电镀废液的浓缩再生,同时利用该电池电解
电镀废液的浓缩再生,同时利用该电池电解 溶液制取
溶液制取 溶液和
溶液和 溶液,装置如图所示,甲、乙两室均预加相同的
溶液,装置如图所示,甲、乙两室均预加相同的 电镀废液,向甲室通入足量氨气后电池开始工作。下列说法错误的是
电镀废液,向甲室通入足量氨气后电池开始工作。下列说法错误的是
A.电池总反应: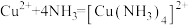 |
| B.电解装置中离子交换膜为阴离子交换膜 |
C.A、B、C对应的物质分别是 、浓 、浓 溶液、 溶液、 溶液 溶液 |
D. 扩散到乙室将对电池电动势产生影响 扩散到乙室将对电池电动势产生影响 |
您最近一年使用:0次
2024-02-02更新
|
129次组卷
|
2卷引用:山东省济南市2023-2024学年高二上学期1月期末化学试题
解题方法
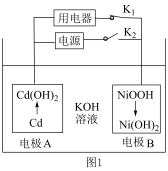
2 . “神舟”飞船中的电池采用太阳能电池阵一镍镉蓄电池组。当飞船进入阴影区
时,由镍镉电池提供电能,其工作原理如图1所示;当飞船进入光照区时,太阳能电池为镍镉电池充电。________ 电极B的电极电势(填“高于”“低于”或“等于”);反应一段时间后,KOH溶液碱性________ (填“增强”“减弱”或“不变”)。
(2)当飞船进入光照区时,电极B上发生反应的电极反应式为________ 。
(3)将图1中用电器换成图2装置,电解含 的水溶液制备金属钴,同时获得高浓度的盐酸。
的水溶液制备金属钴,同时获得高浓度的盐酸。________ 电极相连,离子交换膜2应选择________ (填“阴离子”或“阳离子”)交换膜,石墨电极发生的电极反应式为____________ 。
②当石墨电极收集到5.6L(标准状况下)气体时,有_________ mol离子通过离子交换膜1,此时Ⅲ室溶液质量变化了_________ g。
时,由镍镉电池提供电能,其工作原理如图1所示;当飞船进入光照区时,太阳能电池为镍镉电池充电。
(2)当飞船进入光照区时,电极B上发生反应的电极反应式为
(3)将图1中用电器换成图2装置,电解含
 的水溶液制备金属钴,同时获得高浓度的盐酸。
的水溶液制备金属钴,同时获得高浓度的盐酸。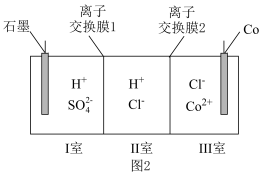
②当石墨电极收集到5.6L(标准状况下)气体时,有
您最近一年使用:0次
3 . 锌离子电池成本低廉、安全性好,其原理如图,放电时电池总反应为:Zn+2MnO2=ZnMn2O4。下列说法错误的是
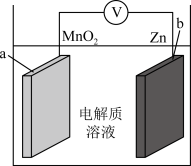

| A.放电时Zn2+由b极区向a极区迁移 |
| B.充电时b极发生还原反应 |
| C.放电时电路中转移1mol电子,a极理论增重65g |
| D.充电时a极反应为ZnMn2O4-2e-=Zn2++2MnO2 |
您最近一年使用:0次
2010·湖南·一模
名校
4 . 如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当电路中通过的电子都是0.1 mol时,下列说法正确的是( )
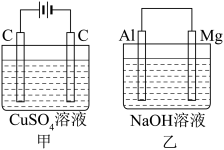

| A.溶液的质量变化:甲减小乙增大 |
| B.溶液pH值变化:甲减小乙增大 |
| C.相同条件下产生气体的体积:V甲=V乙 |
| D.电极反应式:甲中阴极:Cu2++2e﹣=Cu,乙中负极:Mg﹣2e﹣=Mg2+ |
您最近一年使用:0次
2020-01-06更新
|
359次组卷
|
16卷引用:山东省济南市第一中学2017-2018学年高二上学期期末考试化学试题
山东省济南市第一中学2017-2018学年高二上学期期末考试化学试题山东省临沂市第十九中学2017-2018学年高二下学期开学考试化学试题云南省曲靖市罗平县第三中学2019-2020学年高二上学期期末考试化学试题(已下线)2010年湖南省高考适应性测试(理综)化学部分(已下线)2014-2015学年浙江省杭州市西湖高级中学高二10月月考化学试卷2014-2015河北省邢台二中高二上学期第三次月考化学试卷2015届河北省冀州中学高三上学期第四次月考化学试卷2016届江西省吉水中学三校高三上第一次联考化学试卷2016届湖南省祁阳县高三下学期二模理综化学试卷黑龙江省哈尔滨师范大学青冈实验中学2017-2018学年高二上学期期中考试化学试题云南省屏边县民族中学2019-2020学年高二上学期12月月考化学试题专题2 化学反应与能量转化——B拓展区 综合拓展(苏教版必修2)湖南省株洲市第二中学2019-2020学年高二上学期入学考试化学试题甘肃省定西市岷县第一中学2019-2020学年高二下学期开学测试化学试题人教版(2019)高二化学选择性必修1第四章 化学反应与电能 第二节 电解池 课时2 电解原理的应用(已下线)练习9 电解池-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)
5 . 如图所示,某同学以酸性介质的甲醇-氧气燃料电池,在钢材上电镀铝。下列说法正确的是
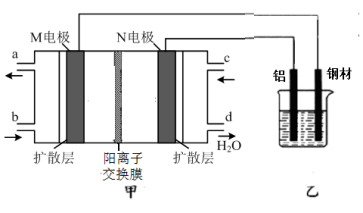

| A.甲装置放电时,电池中的H+向左槽移动 |
| B.M电极的电极反应式为CH3OH-6e-+H2O=CO2+6H+ |
| C.通电前铝和钢材的质量相等,电解一段时间后铝和钢材的质量差增大到5.4g,则理论上甲装置中消耗氧气的体积为1.12 L(标准状况下) |
| D.乙装置中的电解液可以选用氯化铝溶液 |
您最近一年使用:0次
名校
解题方法
6 . (1)2004年美国圣路易斯大学研制了一种新型乙醇电池,该电池采用磺酸类质子溶剂,在200℃左右时供电,电池示意图如下所示:
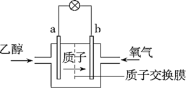
①___ 极(填“a”或“b”)为电池的正极,电池工作时电子的流向为____ (填“a→b”或“b→a”)。
②写出该电池负极的电极反应式:_______________ 。
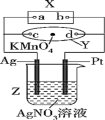
(2)图中X为电源,Y为浸透滴有酚酞试液的饱和食盐水的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。
①Y中总反应的化学方程式为________ ,滤纸上c点附近会变_____ 色。
②电解一段时间后,Z产生280 mL的气体(标准状况下),此时Z中溶液的体积为500 mL,假设溶液中还有AgNO3存在,则溶液中氢离子的物质的量是______ ,需加入____ g的____ (填化学式)可使溶液复原。
(3)氧化还原反应与生产、生活、科技密切相关。请回答下列问题:
①银制器皿久置表面变黑是因为表面生成了Ag2S,该现象属于____ 腐蚀。
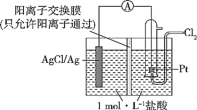
②在如图所示的原电池装置中,负极的电极反应为_________ ,电池总反应为__________ ,当电路中通过0.1 mol e-时,交换膜左侧溶液中离子减少的物质的量为____ 。

①
②写出该电池负极的电极反应式:

(2)图中X为电源,Y为浸透滴有酚酞试液的饱和食盐水的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。
①Y中总反应的化学方程式为
②电解一段时间后,Z产生280 mL的气体(标准状况下),此时Z中溶液的体积为500 mL,假设溶液中还有AgNO3存在,则溶液中氢离子的物质的量是
(3)氧化还原反应与生产、生活、科技密切相关。请回答下列问题:
①银制器皿久置表面变黑是因为表面生成了Ag2S,该现象属于
②在如图所示的原电池装置中,负极的电极反应为

您最近一年使用:0次
2020-10-22更新
|
303次组卷
|
3卷引用:山东省文登第一中学2022-2023学年高二上学期1月期末考试化学试题
名校
7 . 酸性锌锰干电池是一种常用的一次电池,其结构如图所示。该电池在放电过程产生MnOOH和Zn(NH3)2Cl2。回答下列问题:
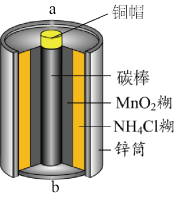
(1)该电池的正极为____ (填“a”或“b”)极,该电池总反应的化学方程式为____ 。
(2)如图为电解100mL2.0mol·L-1CuSO4溶液的装置,该装置的电源为上述酸性锌锰干电池。
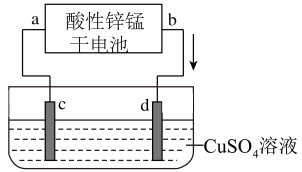
①电解一段时间后,石墨电极d出现的现象为____ ;石墨电极c上的电极反应式为____ 。
②当上述电池消耗3.25gZn时,电解后溶液中c(H+)为_____ (忽略电解前后溶液体积变化)。欲将电解后的溶液恢复至原溶液,应加入的试剂是____ ,其质量为____ g。

(1)该电池的正极为
(2)如图为电解100mL2.0mol·L-1CuSO4溶液的装置,该装置的电源为上述酸性锌锰干电池。

①电解一段时间后,石墨电极d出现的现象为
②当上述电池消耗3.25gZn时,电解后溶液中c(H+)为
您最近一年使用:0次
2022-09-06更新
|
165次组卷
|
4卷引用:山东省菏泽市鄄城县第一中学2022-2023学年高二上学期期末考试化学试题
2010·北京东城·二模
名校
解题方法
8 . 如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是( )
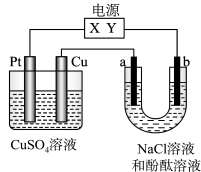
| A.X极是电源负极,Y极是电源正极 |
| B.a极的电极反应是2Cl--2e-=Cl2↑ |
| C.电解过程中CuSO4溶液的pH逐渐增大 |
| D.Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体 |
您最近一年使用:0次
2020-04-24更新
|
347次组卷
|
13卷引用:山东省菏泽市单县二中2022-2023学年高一下学期6月段考化学试题
山东省菏泽市单县二中2022-2023学年高一下学期6月段考化学试题辽宁省营口中学2017-2018学年高二上学期期末考试化学试题江西省九江第一中学2017-2018学年高二上学期期末考试化学试题【全国百强校】黑龙江省大庆实验中学2017-2018学年高二上学期期末考试化学试题黑龙江省双鸭山市第一中学2019-2020学年高二上学期期末考试化学试题(已下线)【南昌新东方】江西省九江第一中学2017-2018学年高二上学期期末考试化学试题河北省安平中学2020-2021学年高一下学期第四次月考(期末)化学试题山东省临沂第十八中学2023-2024学年高一下学期6月份阶段性测试化学试题(已下线)2010年北京市东城区高三第二次模拟考试(理综)化学部分(已下线)2014年高考化学指导冲关 第7练电化学原理练习卷(已下线)2014-2015学年浙江省杭州市西湖高级中学高二10月月考化学试卷辽宁省凌源市第二高级中学2019-2020学年高二下学期第二次网测化学试题(已下线)热点题型训练 电化学串联装置的两大模型
解题方法
9 . 水体中的含氮化合物是引起富营养化的主要污染物,控制水体中的含氮污染物,对水资源的循环利用意义重大。
25℃时,亚硝酸( )和连二次硝酸(
)和连二次硝酸( )的电离常数如下表所示:
)的电离常数如下表所示:
(1)下列不能说明 是弱电解质的是
是弱电解质的是___________ (填序号)。
A.室温下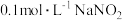 溶液的
溶液的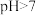
B.用一定浓度的 溶液做导电实验,灯泡很暗
溶液做导电实验,灯泡很暗
C.等pH、等体积的盐酸和 溶液分别与足量锌反应,
溶液分别与足量锌反应, 溶液放出的氢气较多
溶液放出的氢气较多
(2) 溶液呈
溶液呈___________ 性(填“酸”“碱”或“中”),原因是___________ (用离子方程式表示)。
(3)室温下,物质的量浓度相同的溶液: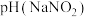
___________ 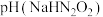 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)25℃时,用 的
的 溶液滴定
溶液滴定 溶液,当两者恰好完全反应生成正盐时,溶液中离子浓度由大到小的顺序为
溶液,当两者恰好完全反应生成正盐时,溶液中离子浓度由大到小的顺序为___________ 。
(5)亚硝酸盐对人体健康的损害不亚于农药,可采用电解含 、
、 废水的方法除去
废水的方法除去 (生成物为
(生成物为 ,同时再生
,同时再生 ,其原理如图所示。
,其原理如图所示。
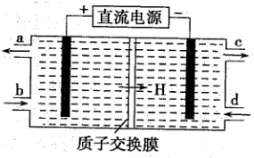
① 从电解槽的
从电解槽的___________ (填字母)口流出。
②写出阴极的电极反应式___________ 。
(6)新的研究表明,将含 的废水与含
的废水与含 的废水按一定比例混合,直接转化为无毒气体,该反应的离子方程式为
的废水按一定比例混合,直接转化为无毒气体,该反应的离子方程式为___________ 。
25℃时,亚硝酸(
 )和连二次硝酸(
)和连二次硝酸( )的电离常数如下表所示:
)的电离常数如下表所示:| 化学式 |  |  |
| 电离常数 | 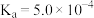 | 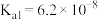 、 、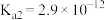 |
(1)下列不能说明
 是弱电解质的是
是弱电解质的是A.室温下
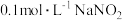 溶液的
溶液的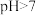
B.用一定浓度的
 溶液做导电实验,灯泡很暗
溶液做导电实验,灯泡很暗C.等pH、等体积的盐酸和
 溶液分别与足量锌反应,
溶液分别与足量锌反应, 溶液放出的氢气较多
溶液放出的氢气较多(2)
 溶液呈
溶液呈(3)室温下,物质的量浓度相同的溶液:
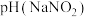
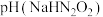 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(4)25℃时,用
 的
的 溶液滴定
溶液滴定 溶液,当两者恰好完全反应生成正盐时,溶液中离子浓度由大到小的顺序为
溶液,当两者恰好完全反应生成正盐时,溶液中离子浓度由大到小的顺序为(5)亚硝酸盐对人体健康的损害不亚于农药,可采用电解含
 、
、 废水的方法除去
废水的方法除去 (生成物为
(生成物为 ,同时再生
,同时再生 ,其原理如图所示。
,其原理如图所示。
①
 从电解槽的
从电解槽的②写出阴极的电极反应式
(6)新的研究表明,将含
 的废水与含
的废水与含 的废水按一定比例混合,直接转化为无毒气体,该反应的离子方程式为
的废水按一定比例混合,直接转化为无毒气体,该反应的离子方程式为
您最近一年使用:0次
名校
10 . 关于下列装置说法正确的是
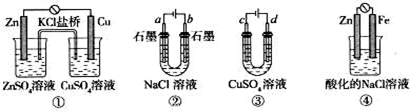

| A.装置①中,盐桥中的K+移向ZnSO4溶液 |
| B.滴有酚酞溶液的装置②在电解过程中,b极先变红 |
| C.可以用装置③在铁上镀铜,d极为铜 |
| D.装置④中发生铁的吸氧腐蚀 |
您最近一年使用:0次
2017-10-21更新
|
773次组卷
|
9卷引用:2014-2015山东省德州市高二2月期末统考化学试卷
2014-2015山东省德州市高二2月期末统考化学试卷山东省济南市第一中学2017-2018学年高二10月阶段测试化学试题【全国百强校】山东省济南第一中学2018-2019学年高二上学期期中考试化学试题山东省德州市陵城区第一中学2019-2020学年高二上学期期中考试化学试题安徽省合肥市一六八中学2019-2020学年高二上学期期末考试化学试题河南省滑县第二高级中学2017-2018学年高二12月月考化学试题河北省唐县第一中学2019届高三上学期期中考试化学试题2020届高三化学化学二轮复习——电解池的基本原理【精编选择24题】人教版(2019)高二选择性必修第一册 第四章 化学反应与电能 第三节 金属的腐蚀与防护2



