名校
解题方法
1 . 填空。
(1)某课外活动小组同学用如图装置(M、N为外电源的两个电极)进行实验,试回答下列问题:
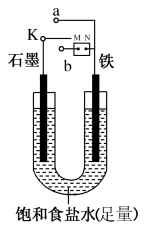
①若开始时开关K与a连接,则铁发生电化学腐蚀中的_____ 腐蚀。请写出正极反应式:____ 。
②若开始时开关K与b连接时,两极均有气体产生,则铁电极为______ 极(填“阴”或“阳”),该电极上发生的电极反应式为_______ ,总反应的离子方程式为_______ 。
③当电路中转移0.2mol电子时,100ml溶液中,NaOH溶液的浓度是_______ mol/L
(2)该小组同学设想,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠。
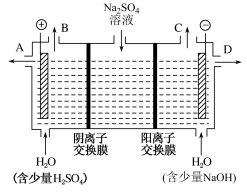
B出口导出的气体是_______ ,制得的氢氧化钠溶液从出口_______ (填“A”、“B”、“C”或“D”)导出。通过阴离子交换膜的离子数_______ (填“>”、“<”或“=”)通过阳离子交换膜的离子数。
(1)某课外活动小组同学用如图装置(M、N为外电源的两个电极)进行实验,试回答下列问题:

①若开始时开关K与a连接,则铁发生电化学腐蚀中的
②若开始时开关K与b连接时,两极均有气体产生,则铁电极为
③当电路中转移0.2mol电子时,100ml溶液中,NaOH溶液的浓度是
(2)该小组同学设想,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠。

B出口导出的气体是
您最近一年使用:0次
名校
解题方法
2 . 如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
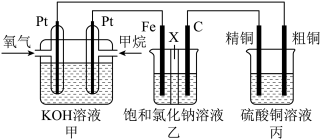
(1)甲是燃料电池,通入甲烷的电极作____ 极(填入“正”或“负”),其电极反应式为:____ 。
(2)乙是____ 池(填“原电池”或“电解池”),乙装置发生电解的总反应离子方程式为____ 。
(3)丙中粗铜作____ 极(填入“阴”或“阳”),若在标准状况下,有2.24L氧气参加反应,丙装置中析出精铜的质量为____ g。

(1)甲是燃料电池,通入甲烷的电极作
(2)乙是
(3)丙中粗铜作
您最近一年使用:0次
2022-10-24更新
|
159次组卷
|
2卷引用:黑龙江省伊春市伊美区第二中学2021-2022学年高二下学期开学考试化学试题
名校
解题方法
3 . 某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量,体积均为1L),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题:
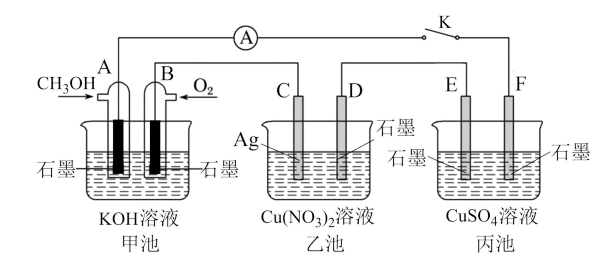
(1)甲、乙、丙三池中为原电池的是___________ (填“甲池”,“乙池”,“丙池”),A电极的电极反应式为___________ 。
(2)丙池中E电极为___________ (填“正极”、“负极”、“阴极”或“阳极”),该池总反应的化学方程式为___________ 。
(3)当甲池中B电极上消耗O2的体积为560mL(标准状况)时,乙池中C极质量理论上减轻___________ g,则丙池溶液的pH为___________
(4)一段时间后,断开电键K,下列物质能使丙池恢复到反应前浓度的是___________ (填选项字母)。

(1)甲、乙、丙三池中为原电池的是
(2)丙池中E电极为
(3)当甲池中B电极上消耗O2的体积为560mL(标准状况)时,乙池中C极质量理论上减轻
(4)一段时间后,断开电键K,下列物质能使丙池恢复到反应前浓度的是___________ (填选项字母)。
| A.Cu | B.CuO | C.CuCO3 | D.Cu(OH)2 |
您最近一年使用:0次
2022-01-02更新
|
660次组卷
|
5卷引用: 黑龙江省大庆市大庆中学2022-2023学年高二下学期开学考试化学试题
黑龙江省大庆市大庆中学2022-2023学年高二下学期开学考试化学试题黑龙江省双鸭山市第一中学2021-2022学年高二上学期期末考试化学试题(已下线)专题29 电化学计算的三种常用方法-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)河南省焦作市温县第一高级中学2021-2022学年高二下学期2月月考化学试题(已下线)电化学原理及应用
名校
解题方法
4 . 电化学知识在物质制备领域的应用前景看好。
(1)利用反应6NO2+8NH3= 7N2 + 12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。

①A电极的电极反应式为___________ 。
②下列关于该电池的说法正确的是___________ 。
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一段时间,溶液的pH不变
D.当有4.48LNO2被处理时,转移电子物质的量为0.8mol
(2)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:

①B极上的电极反应式为___________ 。
②若用该燃料电池作电源,用石墨作电极电解硫酸铜溶液,当阳极收集到11.2 L(标准状况)气体时,消耗甲烷的体积为___________ L(标准状况下)。
(3)阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。生产流程如下图所示:

①电解饱和食盐水的化学方程式为___________ 。
②电解结束后,能够脱去阳极液中游离氯的试剂或方法是___________ (填字母序号)。
A.Na2SO4 B.Na2SO3
C.热空气吹出 D.降低阳极区液面上方的气压
(4)按如图1所示装置进行电解,A、B、C、D均为铂电极,回答下列问题。

已知一:甲槽电解的是200 mL一定浓度的NaCl与CuSO4的混合溶液,理论上两极所得气体体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计)。
①原混合溶液中NaCl的物质的量浓度为___________ mol·L-1,CuSO4的物质的量浓度为___________ mol·L-1。
已知二:乙槽为200 mL CuSO4溶液:
②当C极析出0.64 g物质时,乙槽溶液中生成的H2SO4为___________ mol。电解后,若使乙槽内的溶液完全复原,可向乙槽中加入___________ 。
A.Cu(OH)2 B.CuO C.CuCO3 D.Cu2(OH)2CO3
③若通电一段时间后,向所得的乙槽溶液中加入0.2 mol的Cu(OH)2才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为___________ (用NA表示)。
(1)利用反应6NO2+8NH3= 7N2 + 12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。

①A电极的电极反应式为
②下列关于该电池的说法正确的是
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一段时间,溶液的pH不变
D.当有4.48LNO2被处理时,转移电子物质的量为0.8mol
(2)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:

①B极上的电极反应式为
②若用该燃料电池作电源,用石墨作电极电解硫酸铜溶液,当阳极收集到11.2 L(标准状况)气体时,消耗甲烷的体积为
(3)阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。生产流程如下图所示:

①电解饱和食盐水的化学方程式为
②电解结束后,能够脱去阳极液中游离氯的试剂或方法是
A.Na2SO4 B.Na2SO3
C.热空气吹出 D.降低阳极区液面上方的气压
(4)按如图1所示装置进行电解,A、B、C、D均为铂电极,回答下列问题。

已知一:甲槽电解的是200 mL一定浓度的NaCl与CuSO4的混合溶液,理论上两极所得气体体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计)。
①原混合溶液中NaCl的物质的量浓度为
已知二:乙槽为200 mL CuSO4溶液:
②当C极析出0.64 g物质时,乙槽溶液中生成的H2SO4为
A.Cu(OH)2 B.CuO C.CuCO3 D.Cu2(OH)2CO3
③若通电一段时间后,向所得的乙槽溶液中加入0.2 mol的Cu(OH)2才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为
您最近一年使用:0次
2021-08-26更新
|
870次组卷
|
2卷引用:黑龙江省大庆铁人中学2021-2022学年高二上学期开学考试化学试题
解题方法
5 . 回答下列问题:
(1)纳米级Cu2O由于具有优良的催化性能而受到关注,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中c(OH-)制备纳米Cu2O,其装置如图甲、乙。


①上述装置中D电极应连接肼燃料电池的____ 极(填“A”或“B”)
②该电解池的阳极反应式为________
③当反应生成14.4g Cu2O时,至少需要肼________ mol。
(1)纳米级Cu2O由于具有优良的催化性能而受到关注,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中c(OH-)制备纳米Cu2O,其装置如图甲、乙。


①上述装置中D电极应连接肼燃料电池的
②该电解池的阳极反应式为
③当反应生成14.4g Cu2O时,至少需要肼
您最近一年使用:0次
6 . 纳米级Cu2O由于具有优良的催化性能而受到关注,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中c(OH-)制备纳米Cu2O,其装置如图甲、乙。
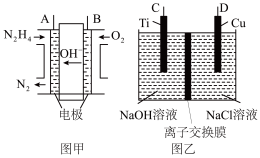
(1)上述装置中D电极应连接肼燃料电池的________ 极(填“A”或“B”),该电解池中离子交换膜为________ 离子交换膜(填“阴”或“阳”)。
(2)该电解池的阳极反应式为________________________________________ ,
肼燃料电池中A极发生的电极反应为____________________________ 。
(3)当反应生成14.4 g Cu2O时,至少需要肼________ mol。

(1)上述装置中D电极应连接肼燃料电池的
(2)该电解池的阳极反应式为
肼燃料电池中A极发生的电极反应为
(3)当反应生成14.4 g Cu2O时,至少需要肼
您最近一年使用:0次
2019-11-19更新
|
194次组卷
|
6卷引用:黑龙江省齐齐哈尔三立高级中学2022届高三上学期开学考试化学试题
黑龙江省齐齐哈尔三立高级中学2022届高三上学期开学考试化学试题辽宁省六校协作体2019-2020学年高二上学期期中考试化学试题江苏省苏州市相城区陆慕高级中学2019-2020高二下学期4月质量检测化学试题(已下线)综合复习与测试(1)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)河北定州中学2023-2024学年高二上学期12月月考化学试题山西省朔州市怀仁市大地学校高中部2023-2024学年高二上学期12月月考化学试题
名校
7 . 如图所示三套实验装置,分别回答下列问题.
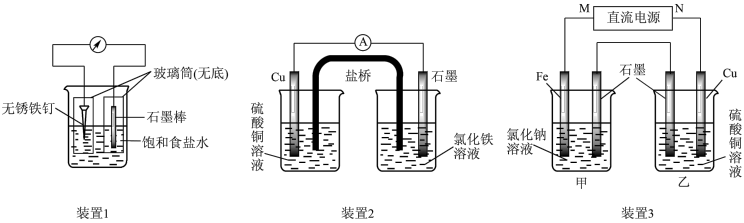
(1)装置1为铁的吸氧腐蚀实验.向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为______ .
(2)装置2中的石墨是______ 极(填“正”或“负”),该装置发生的总反应的离子方程式为______ .
(3)装置3中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100mL 0.5mol/L的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红.
①电源的M端为______ 极;甲烧杯中铁电极的电极反应为______ .
②乙烧杯中电解反应的离子方程式为______ .
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64g,甲烧杯中产生的气体标准状况下体积为______ mL.

(1)装置1为铁的吸氧腐蚀实验.向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为
(2)装置2中的石墨是
(3)装置3中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100mL 0.5mol/L的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红.
①电源的M端为
②乙烧杯中电解反应的离子方程式为
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64g,甲烧杯中产生的气体标准状况下体积为
您最近一年使用:0次
2019-11-04更新
|
112次组卷
|
2卷引用:黑龙江省哈尔滨师范大学青冈实验中学校2020-2021学年高二上学期开学考试化学试题
名校
8 . 氢氧燃料电池是一种新型的化学电源,其构造如图一所示:a、b两个电极均由多孔碳制成,通入的气体由孔隙中逸出,并在电极表面放电。

(1)a电极反应式是_______________________ ;
(2)该燃料电池生成了360 kg的水,则电路中通过了_____________ mol的电子。
(3)用如图二所示电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极反应式是___________________ 。
②Y电极的材料是______________ 。

(1)a电极反应式是
(2)该燃料电池生成了360 kg的水,则电路中通过了
(3)用如图二所示电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极反应式是
②Y电极的材料是
您最近一年使用:0次
解题方法
9 . 如下图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
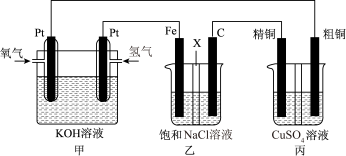
根据要求回答相关问题:
(1)通入氧气的电极为________ (填“正极”或“负极”),负极的电极反应式为______________ 。
(2)铁电极为________ (填“阳极”或“阴极”),石墨电极(C)的电极反应式为_______________ 。
(3)反应一段时间后,乙装置中生成氢氧化钠主要在________ 区。(填“铁极”或“石墨极”)
(4)如果粗铜中含有锌、银等杂质,则丙装置中反应一段时间后,硫酸铜溶液浓度将________ (填“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为________ ;丙装置中阴极析出铜的质量为_______ 。

根据要求回答相关问题:
(1)通入氧气的电极为
(2)铁电极为
(3)反应一段时间后,乙装置中生成氢氧化钠主要在
(4)如果粗铜中含有锌、银等杂质,则丙装置中反应一段时间后,硫酸铜溶液浓度将
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为
您最近一年使用:0次
2016-12-09更新
|
161次组卷
|
5卷引用:黑龙江省嫩江市第一中学2021-2022学年高二下学期开学考试化学试题
黑龙江省嫩江市第一中学2021-2022学年高二下学期开学考试化学试题(已下线)2011-2012学年辽南协作体高二上学期期中考试化学试卷2015-2016学年山东省淄博六中高二上学期期末化学试卷河北省鸡泽县第一中学2016-2017学年高一下学期期中考试化学试题河南省郑州市中牟县二中2017-2018学年高二第一次月考化学试题



