名校
解题方法
1 . 应用电化学原理,回答下列问题。
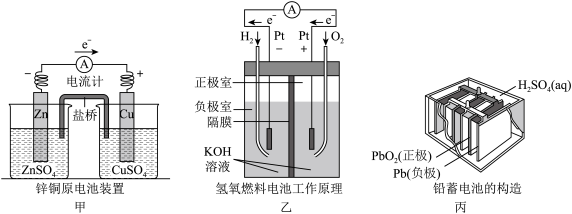
(1)甲中电流计指针偏移时,盐桥(装含琼脂的饱和 溶液)中离子移动的方向:
溶液)中离子移动的方向:_______ 离子移向硫酸锌溶液。
(2)乙中正极反应式为_______ ;若将 换成
换成 ,则负极反应式为
,则负极反应式为_______ 。
(3)丙中铅蓄电池放电一段时间后,进行充电时,要将外接电源的负极与铅蓄电池_______ 极相连接。
(4)海水中锂元素储量非常丰富,锂是制造化学电源的重要原料,如 电池某电极的工作原理如下图所示:
电池某电极的工作原理如下图所示:

该电池电解质为传导 的固体材料。放电时
的固体材料。放电时 电极是电池的
电极是电池的_______ 极(填“正”或“负”),电极反应式为_______ 。
(5)应用原电池反应可以探究氧化还原反应进行的方向和程度。现连接如图装置并加入药品(盐桥中的物质不参与反应),进行实验:
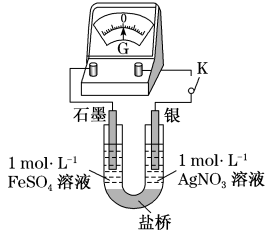
ⅰ.K闭合时,指针偏移。放置一段时间后,指针偏移减小。
ⅱ.随后向U形管左侧逐渐加入浓 溶液,发现电流表指针的变化依次为偏移减小→回到零点→逆向偏移。
溶液,发现电流表指针的变化依次为偏移减小→回到零点→逆向偏移。
①实验ⅰ中银作_______ 极。
②综合实验i、ii的现象,得出 和
和 反应的离子方程式是
反应的离子方程式是_______ 。

(1)甲中电流计指针偏移时,盐桥(装含琼脂的饱和
 溶液)中离子移动的方向:
溶液)中离子移动的方向:(2)乙中正极反应式为
 换成
换成 ,则负极反应式为
,则负极反应式为(3)丙中铅蓄电池放电一段时间后,进行充电时,要将外接电源的负极与铅蓄电池
(4)海水中锂元素储量非常丰富,锂是制造化学电源的重要原料,如
 电池某电极的工作原理如下图所示:
电池某电极的工作原理如下图所示:
该电池电解质为传导
 的固体材料。放电时
的固体材料。放电时 电极是电池的
电极是电池的(5)应用原电池反应可以探究氧化还原反应进行的方向和程度。现连接如图装置并加入药品(盐桥中的物质不参与反应),进行实验:

ⅰ.K闭合时,指针偏移。放置一段时间后,指针偏移减小。
ⅱ.随后向U形管左侧逐渐加入浓
 溶液,发现电流表指针的变化依次为偏移减小→回到零点→逆向偏移。
溶液,发现电流表指针的变化依次为偏移减小→回到零点→逆向偏移。①实验ⅰ中银作
②综合实验i、ii的现象,得出
 和
和 反应的离子方程式是
反应的离子方程式是
您最近一年使用:0次
2022-11-17更新
|
284次组卷
|
3卷引用:江西省抚州市金溪一中等三校2022-2023年高二上学期第二次联考化学试题
2 . 相同金属在其不同浓度盐溶液中可形成浓差电池,当两个电极区的浓度相等时停止放电。如图所示装置是利用浓差电池电解 溶液(a、b电极均为石墨电极),可以制得
溶液(a、b电极均为石墨电极),可以制得 、
、 、
、 和NaOH,实验前Cu(I)电极和Cu(II)电极质量相等。
和NaOH,实验前Cu(I)电极和Cu(II)电极质量相等。
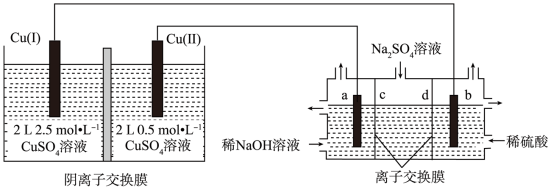
(1)Cu(I)电极为_______ 极,a电极的电极反应为_______ 。
(2)c膜为_______ (填“阳离子交换膜”或“阴离子交换膜”)。
(3)电池从开始工作到停止放电,Cu(I)电极和Cu(II)电极质量差为_______ g,电解池理论上可制得_______ gNaOH。
 溶液(a、b电极均为石墨电极),可以制得
溶液(a、b电极均为石墨电极),可以制得 、
、 、
、 和NaOH,实验前Cu(I)电极和Cu(II)电极质量相等。
和NaOH,实验前Cu(I)电极和Cu(II)电极质量相等。
(1)Cu(I)电极为
(2)c膜为
(3)电池从开始工作到停止放电,Cu(I)电极和Cu(II)电极质量差为
您最近一年使用:0次
名校
解题方法
3 . 降低能耗是氯碱工业发展的重要方向。
(1)我国利用氯碱厂生产的H2作燃料,将氢燃料电站应用于氯碱工业,其示意图如图。
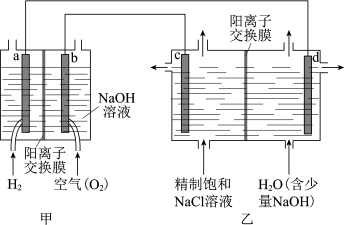
①a极为_______ (填“正”或“负”)极。
②乙装置中电解饱和NaCl溶液的化学方程式为。_______ 。
③下列说法正确的是_______ 。
A.甲装置可以实现化学能向电能转化
B.甲装置中Na+透过阳离子交换膜向a极移动
C.乙装置中c极一侧流出的是淡盐水
④实际生产中,阳离子交换膜的损伤会造成OH- 迁移至阳极区,从而在电解池阳极能检测到O2,产生O2的电极反应式为_______ 。下列生产措施有利于提高Cl2产量、降低阳极O2含量的是_______ 。
A.定期检查并更换阳离子交换膜
B.向阳极区加入适量盐酸
C.使用Cl-浓度高的精制饱和食盐水为原料
(2)降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2,避免水电离的H+直接得电子生成H2,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为_______ 。
(1)我国利用氯碱厂生产的H2作燃料,将氢燃料电站应用于氯碱工业,其示意图如图。

①a极为
②乙装置中电解饱和NaCl溶液的化学方程式为。
③下列说法正确的是
A.甲装置可以实现化学能向电能转化
B.甲装置中Na+透过阳离子交换膜向a极移动
C.乙装置中c极一侧流出的是淡盐水
④实际生产中,阳离子交换膜的损伤会造成OH- 迁移至阳极区,从而在电解池阳极能检测到O2,产生O2的电极反应式为
A.定期检查并更换阳离子交换膜
B.向阳极区加入适量盐酸
C.使用Cl-浓度高的精制饱和食盐水为原料
(2)降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2,避免水电离的H+直接得电子生成H2,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为
您最近一年使用:0次
2022-04-12更新
|
208次组卷
|
9卷引用:江西省临川一中暨临川一中实验学校2021-2022学年高二上学期期末考试化学试题
江西省临川一中暨临川一中实验学校2021-2022学年高二上学期期末考试化学试题江西省南昌市第二中学2020-2021学年高二上学期期末考试化学试题吉林省长春市清蒲中学2021-2022学年高二上学期期末考试化学试题吉林省长春市清蒲中学2021-2022学年高二上学期期末考试化学试题吉林省永吉县第四中学2022-2023学年高二上学期期末考试化学试题北京市西城区2020-2021学年高二上学期期末考试化学试题北京师范大学第二附属中学未来科技城学校2021-2022学年高二上学期期中考试化学试题北京三中2021-2022学年高二上学期期中考试化学试题天津市武清区杨村第一中学2023-2024学年高三上学期第三次质量检测化学试题
4 . 锂电池应用广泛,大致可分为锂金属电池和锂离子电池。锂离子电池工作原理:以石墨/锂钴氧电池为例,其总反应方程式为: 【提示:在
【提示:在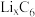 物质中,可以理解为锂元素的化合价为零价。】
物质中,可以理解为锂元素的化合价为零价。】

试回答下列问题:
(1)连接 、
、 时,被还原的物质是
时,被还原的物质是_______ 。
(2)连接 、
、 时,b极发生反应的电极反应式是
时,b极发生反应的电极反应式是_______ 。
(3)连接 、
、 时,a作
时,a作_______ 极。
(4)锂离子电池的电极废料(含 )中的金属可回收利用。
)中的金属可回收利用。
①将电极废料磨碎后用酸浸出,磨碎的目的是_______ 。
②将电极废料用盐酸浸出,得到含 、
、 的溶液,并有黄绿色气体生成,则该反应的化学方程式是
的溶液,并有黄绿色气体生成,则该反应的化学方程式是_______ 。
 【提示:在
【提示:在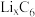 物质中,可以理解为锂元素的化合价为零价。】
物质中,可以理解为锂元素的化合价为零价。】
试回答下列问题:
(1)连接
 、
、 时,被还原的物质是
时,被还原的物质是(2)连接
 、
、 时,b极发生反应的电极反应式是
时,b极发生反应的电极反应式是(3)连接
 、
、 时,a作
时,a作(4)锂离子电池的电极废料(含
 )中的金属可回收利用。
)中的金属可回收利用。①将电极废料磨碎后用酸浸出,磨碎的目的是
②将电极废料用盐酸浸出,得到含
 、
、 的溶液,并有黄绿色气体生成,则该反应的化学方程式是
的溶液,并有黄绿色气体生成,则该反应的化学方程式是
您最近一年使用:0次
名校
5 . 二甲醚(CH3OCH3)被称为 21 世纪的新型燃料,它清洁、高效、具有优良的环保性能,二甲醚是种无色气体,具有轻微的醚香味,二甲醚可作燃料电池的燃料。
(1)以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。请写出该电池中负极上的电极反应式是:___________ 。
(2)用(1)中的燃料电池为电源,以石墨为电极电解500mLNaCl溶液,装置如图甲所示。

①请写出电解过程中总反应的离子方程式___________ 。
②当燃料电池消耗 2.8 LO2 (标准状况下)时,计算此时:NaCl 溶液中c(OH-)=___________ mol/L (假设溶液的体积不变,气体全部从溶液中逸出)。
③短暂电解之后,要使溶液恢复原状,应该向溶液中加入物质___________ (填名称)。
(3)用(1)中的燃料电池为电源,用离子交换膜控制电解液中c(OH-)制备纳米Cu2O,其装置如图乙所示。
①上述装置中 D电极应连接二甲醚燃料电池的___________ (填“正极”或“负极”),该电解池中离子交换膜为___________ 离子交换膜(填“阴”或“阳”)。
②该电解池的阳极反应式为___________ 。
(1)以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。请写出该电池中负极上的电极反应式是:
(2)用(1)中的燃料电池为电源,以石墨为电极电解500mLNaCl溶液,装置如图甲所示。

①请写出电解过程中总反应的离子方程式
②当燃料电池消耗 2.8 LO2 (标准状况下)时,计算此时:NaCl 溶液中c(OH-)=
③短暂电解之后,要使溶液恢复原状,应该向溶液中加入物质
(3)用(1)中的燃料电池为电源,用离子交换膜控制电解液中c(OH-)制备纳米Cu2O,其装置如图乙所示。
①上述装置中 D电极应连接二甲醚燃料电池的
②该电解池的阳极反应式为
您最近一年使用:0次
2021-02-05更新
|
357次组卷
|
3卷引用:江西省新余市2021-2022学年高二上学期期末检测化学试题



