1 . 污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的产品。
治理方案Ⅰ:
(1)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:_______________ 、_______________ 。
治理方案Ⅱ:
某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下流程既去除尾气中的SO2,又制得电池材料MnO2 (反应条件已省略)。
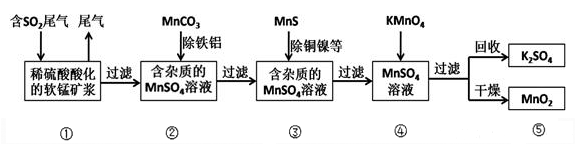
请回答下列问题:
(2)用MnCO3能除去溶液中Al3+和Fe3+其原因是___________________________ ,用MnS除去溶液中的Cu2+的离子方程式为_______________ 。
(3)流程图④过程中发生的主要反应的化学方程式为___________________ 。
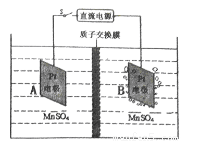
(4)MnO2可作超级电容器材料。工业上用下图所示装置制备MnO2。接通电源后,A电极的电极反应式为:_______________ ,当制备lmol MnO2,则膜两侧电解液的质量变化差(△m左-△m右)为_______________ g。
治理方案Ⅰ:
(1)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:
治理方案Ⅱ:
某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下流程既去除尾气中的SO2,又制得电池材料MnO2 (反应条件已省略)。

请回答下列问题:
(2)用MnCO3能除去溶液中Al3+和Fe3+其原因是
(3)流程图④过程中发生的主要反应的化学方程式为
(4)MnO2可作超级电容器材料。工业上用下图所示装置制备MnO2。接通电源后,A电极的电极反应式为:

您最近一年使用:0次
2 . 关于下图装置中的变化叙述错误的是
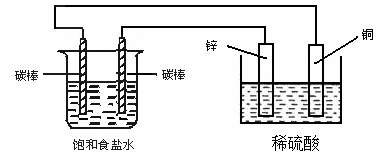
| A.电子经导线从锌片流向右侧碳棒,再从左侧碳棒流回铜片 |
| B.右侧碳棒上发生的电极反应:2H++2e-→H2↑ |
| C.左侧碳棒发生还原反应 |
| D.铜电极出现气泡 |
您最近一年使用:0次
2017-04-14更新
|
290次组卷
|
2卷引用:辽宁省六校协作体2016-2017学年高二6月联考化学试题
3 . 以甲醇燃料电池(KOH电解质)为电源,在实验室中模拟铝制品表面“钝化”处理的过程。实验中,通电一段时间后可观察到铝电极逐渐失去光泽,并出现细小气泡,装置如图所示,下列说法正确的是
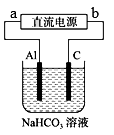

| A.燃料电池b电极上发生的反应为:CH4O-6e-+H2O=6H++CO2↑ |
| B.电解池中石墨电极做阴极,发生反应为:2H++2e-=H2↑ |
| C.电解池中Al电极上的反应为:Al-3e-+3HCO3-=AI(OH)3↓+3CO2↑ |
| D.理论上每生成19.5 g沉淀,标准状况下a电极上消耗掉O22.1 L |
您最近一年使用:0次
名校
4 . 如图甲是利用一种微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜。下列说法中正确的是( )
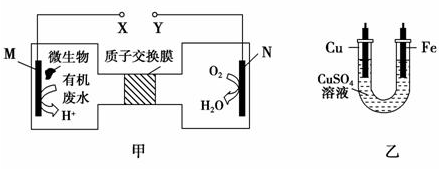

| A.铜电极应与X相连接 |
| B.H+经过质子交换膜由右向左移动 |
| C.当N电极消耗0.25mol气体时,则铁电极增重16g |
| D.M电极反应式:CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+ |
您最近一年使用:0次
2017-03-11更新
|
1028次组卷
|
10卷引用:辽宁省师范大学附属中学2018届高三上学期期中考试化学试题
辽宁省师范大学附属中学2018届高三上学期期中考试化学试题辽宁师大附中2017-2018学年第一学期期中考试高三化学试卷【全国百强校】辽宁省沈阳市东北育才学校2018-2019学年高二上学期第二次月考化学试题2017届四川省乐山市高三第二次调查研究考试理科综合化学试卷河南省郑州市2017届高三第三次模拟考试理综化学试题河南省洛阳市2018届高三上学期尖子生第一次联考化学试题湖南省师范大学附属中学2018届高三上学期10月月考试卷(二)化学试题山西省吕梁市2018届高三上学期第一次阶段性测试化学试题河南省汝州市实验中学2019届高三上学期期末模拟化学试题四川省凉山州宁南中学2021-2022学年高二下学期期末零诊模拟考试化学试题
名校
5 . 如图所示:
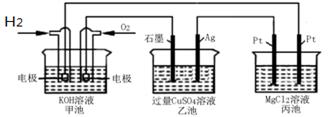
下列说法正确的是

下列说法正确的是
| A.甲池通入O2的电极反应为O2 + 4e-+ 4H+=2H2O |
| B.乙池 Ag电极增重6.4g,溶液中将转移0.2mol电子 |
| C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 |
| D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体 |
您最近一年使用:0次
2016-12-09更新
|
854次组卷
|
5卷引用:2017届辽宁省鞍山一中高三上模拟一化学试卷
11-12高二上·辽宁·期中
解题方法
6 . 如下图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
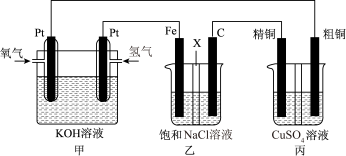
根据要求回答相关问题:
(1)通入氧气的电极为________ (填“正极”或“负极”),负极的电极反应式为______________ 。
(2)铁电极为________ (填“阳极”或“阴极”),石墨电极(C)的电极反应式为_______________ 。
(3)反应一段时间后,乙装置中生成氢氧化钠主要在________ 区。(填“铁极”或“石墨极”)
(4)如果粗铜中含有锌、银等杂质,则丙装置中反应一段时间后,硫酸铜溶液浓度将________ (填“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为________ ;丙装置中阴极析出铜的质量为_______ 。

根据要求回答相关问题:
(1)通入氧气的电极为
(2)铁电极为
(3)反应一段时间后,乙装置中生成氢氧化钠主要在
(4)如果粗铜中含有锌、银等杂质,则丙装置中反应一段时间后,硫酸铜溶液浓度将
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为
您最近一年使用:0次
2016-12-09更新
|
162次组卷
|
5卷引用:2011-2012学年辽南协作体高二上学期期中考试化学试卷
(已下线)2011-2012学年辽南协作体高二上学期期中考试化学试卷2015-2016学年山东省淄博六中高二上学期期末化学试卷河北省鸡泽县第一中学2016-2017学年高一下学期期中考试化学试题河南省郑州市中牟县二中2017-2018学年高二第一次月考化学试题黑龙江省嫩江市第一中学2021-2022学年高二下学期开学考试化学试题
7 . 已知H2O2是一种弱酸,在强碱溶液中主要以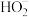 形式存在。现以Al−H2O2燃料电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(电解池中隔膜仅阻止气体通过,c、d均为惰性电极)。下列说法正确的是
形式存在。现以Al−H2O2燃料电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(电解池中隔膜仅阻止气体通过,c、d均为惰性电极)。下列说法正确的是
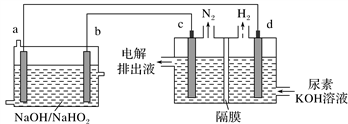
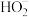 形式存在。现以Al−H2O2燃料电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(电解池中隔膜仅阻止气体通过,c、d均为惰性电极)。下列说法正确的是
形式存在。现以Al−H2O2燃料电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(电解池中隔膜仅阻止气体通过,c、d均为惰性电极)。下列说法正确的是
A.燃料电池的总反应为:2Al+3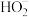  2 2 +2H2O +2H2O |
| B.电解时,Al消耗2.7 g,则产生氮气的体积为1.12 L |
| C.电极b是负极,且反应后该电极区pH增大 |
| D.电解过程中,电子的流向:a→d,c→b |
您最近一年使用:0次
2016-12-09更新
|
385次组卷
|
3卷引用:2016届辽宁省大连二十四中高三上学期期中测试化学试卷
名校
8 . 装置(Ⅰ)为铁镍(Fe-Ni)可充电电池:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,Y附近溶液先变红。下列说法正确的是
Fe(OH)2+Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,Y附近溶液先变红。下列说法正确的是
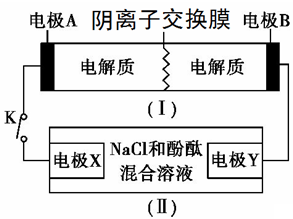
 Fe(OH)2+Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,Y附近溶液先变红。下列说法正确的是
Fe(OH)2+Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,Y附近溶液先变红。下列说法正确的是
| A.闭合K时,X的电极反应式为:2H++2e-= H2↑ |
| B.闭合K时,A电极反应式为:NiO2+2e-+2H+= Ni(OH)2 |
| C.给装置(Ⅰ)充电时,B极参与反应的物质被氧化 |
| D.给装置(Ⅰ)充电时,OH- 通过阴离子交换膜,移向A电极 |
您最近一年使用:0次
2016-12-09更新
|
481次组卷
|
6卷引用:2016届辽宁省东北育才学校高三上学期第二次模拟测试化学试卷
名校
9 . 下列关于电化学的叙述正确的是
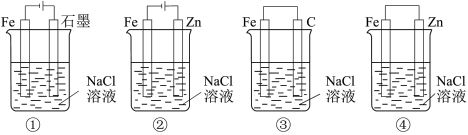

| A.图①两极均有气泡产生,滴加酚酞溶液时石墨一极变红 |
| B.图②装置可以验证牺牲阳极的阴极保护法 |
| C.图③可以模拟钢铁的吸氧腐蚀,碳棒一极的电极反应式:O2+2H2O+4e-=4OH- |
| D.分别给上述4个装置的铁电极附近滴加少量K3[Fe(CN)6]溶液,②④出现蓝色沉淀 |
您最近一年使用:0次
2016-12-09更新
|
246次组卷
|
6卷引用:2015届北京市石景山区高三一模理综化学试卷
名校
10 . 碱性硼化钒(VB2)—空气电池工作时反应为:4VB2 + 11O2 = 4B2O3 + 2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是
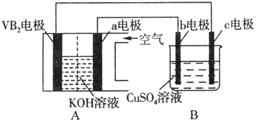

| A.VB2电极发生的电极反应为:2VB2 + 11H2O - 22e- = V2O5 + 2B2O3 + 22H+ |
| B.外电路中电子由c电极流向VB2电极 |
| C.电解过程中,c电极表面先有红色物质析出,后有气泡产生 |
| D.若B装置内的液体体积为100 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L |
您最近一年使用:0次
2016-12-09更新
|
329次组卷
|
4卷引用:2015届哈师附中、东北师附、辽宁实验高三一模联考化学试卷



