2015届浙江省台州市路桥区高三高考模拟三理综化学试卷
浙江
高三
一模
2017-07-26
670次
整体难度:
适中
考查范围:
化学反应原理、常见无机物及其应用、物质结构与性质、化学实验基础、有机化学基础、认识化学科学
2015届浙江省台州市路桥区高三高考模拟三理综化学试卷
浙江
高三
一模
2017-07-26
670次
整体难度:
适中
考查范围:
化学反应原理、常见无机物及其应用、物质结构与性质、化学实验基础、有机化学基础、认识化学科学
一、单选题 添加题型下试题
单选题
|
适中(0.64)
1. 下列相关化学知识的说法正确的是
| A.利用外接直流电源保护铁质建筑物,属于电化学中牺牲阳极的阴极保护法 |
| B.分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法 |
| C.蛋白质和油脂在一定条件下都能水解,水解产物不同,但两者都属于高分子化合物 |
| D.分子数为NA的C2H4气体体积约为 22.4 L,其质量为 28 g(N A-阿伏加德罗常数) |
【知识点】 金属的电化学腐蚀与防护
您最近一年使用:0次
单选题
|
适中(0.65)
2. 下列有关实验设计或操作、观察或记录、结论或解释都不正确的是
| 选项 | 实验设计或操作 | 观察或记录 | 结论或解释 |
| A | 将少量浓硝酸分多次加入Cu和稀硫酸的混合液中 | 可看到红棕色气体,后出现无色气体 | 硝酸的还原产物是NO,红棕色是因为NO与空气中的氧气反应所生成的。 |
| B | 某粉末用酒精润湿后,用铂丝蘸取做焰色反应 | 火焰呈黄色 | 该粉末一定不含钾盐 |
| C | 在AlCl3和MgCl2的混合液中加入过量NaOH溶液 | 先生成白色沉淀,后沉淀部分溶解 | 金属性Na>Mg>Al |
| D | 将盛水的分液漏斗先静置,再旋转180度,再倒置 | 漏斗口和活塞不渗水 | 分液漏斗不漏液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中(0.65)
3. 已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高正价与最低负价的绝对值相等,Z的核电荷数是Y的2倍,W的最外层电子数是最内层电子数的3倍。下列说法不正确的是
| A.化合物YR4中各原子均满足8电子稳定结构 |
| B.对应原子半径:Z<W<R |
| C.W与X、W与Y形成的化合物化学键类型完全相同 |
| D.Y的最高价氧化物对应的水化物是弱酸 |
您最近一年使用:0次
单选题
|
较易(0.85)
4. 下列说法不正确的是
A.某有机物的结构简式如图所示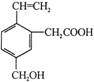 ,该物质属于芳香族化合物是苯的含氧衍生物,含有两种含氧官能团 ,该物质属于芳香族化合物是苯的含氧衍生物,含有两种含氧官能团 |
| B.按系统命名法,有机物(CH3)2CHCH(CH2CH3)(CH2CH2CH3)的命名为:2-甲基-3-乙基己烷 |
| C.总质量一定时,乙炔和乙醛无论按什么比例混合,完全燃烧消耗氧气量或生成CO2量不变 |
| D.丙烯酸(CH2=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)不是同系物,它们与氢气充分反应后的产物才是同系物。 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
5. 碱性硼化钒(VB2)—空气电池工作时反应为:4VB2 + 11O2 = 4B2O3 + 2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是
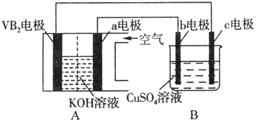

| A.VB2电极发生的电极反应为:2VB2 + 11H2O - 22e- = V2O5 + 2B2O3 + 22H+ |
| B.外电路中电子由c电极流向VB2电极 |
| C.电解过程中,c电极表面先有红色物质析出,后有气泡产生 |
| D.若B装置内的液体体积为100 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L |
您最近一年使用:0次
2016-12-09更新
|
329次组卷
|
4卷引用:2015届哈师附中、东北师附、辽宁实验高三一模联考化学试卷
单选题
|
适中(0.65)
6. 常温下,向某浓度H2A溶液中逐滴加入一定量浓度NaOH溶液,所得溶液中H2A、HA﹣、A2﹣三种微粒的物质的量分数与溶液pH的关系如图所示,则下列说法中不正确的是


| A.H2A是一种二元弱酸 |
| B.将相同物质的量的NaHA和Na2A固体溶于水所得混合溶液pH一定为5.5 |
| C.常温下,H2A=H++HA﹣的电离平衡常数Ka1=0.01 |
| D.在量热计中,用20.0mL0.10mol/LNaOH溶液,分别与10.0mL0.20mol/LH2A和20.0mL0.10mol/LH2A反应后放出的热量不相同 |
您最近一年使用:0次
单选题
|
适中(0.65)
7. 某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0. 1mol/L(此数值忽略水的电离及离子的水解)。
甲同学欲探究废水的组成,进行了如下实验:

Ⅰ、取该无色溶液5mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ、用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ、另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
IV、向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
下列推断不正确的是:
甲同学欲探究废水的组成,进行了如下实验:

Ⅰ、取该无色溶液5mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ、用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ、另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
IV、向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
下列推断不正确的是:
| A.由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是K+、NH4+、Cu2+ |
| B.Ⅲ中加入盐酸生成无色气体的离子方程式是6I-+2NO3-+8H+═3I2+2NO↑+4H2O |
| C.原溶液一定只含有的离子I-、NO3-,SO42-,Mg2+、Al3+ |
| D.另取1OOmL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为0.4 g |
【知识点】 离子共存 离子反应在化合物组成的分析、鉴定的应用解读 离子的检验
您最近一年使用:0次
二、解答题 添加题型下试题
解答题-有机推断题
|
适中(0.65)
解题方法
8. 工业上从煤干馏粗产品煤焦油中可以分离出萘,以萘为主要原料合成除草剂敌草胺的流程图如下:
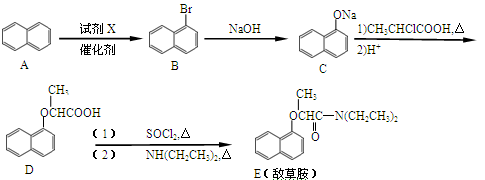
(1)A的分子式_______ ,A生成B时,有另一种一溴代物副产物,它的结构简式为_____ 。
(2)试剂X是_____ 。
(3)向C的水溶液中通入少量的二氧化碳会析出有机物W和无机物,写出化学反应方程式:______ ;
W是一种常用的抗氧剂,理由是_______ 。
(4)试写出由煤焦油中可以分离出苯为原料,无机试剂任选,写出由苯合成苯酚的化学方程式_______ 。

(1)A的分子式
(2)试剂X是
(3)向C的水溶液中通入少量的二氧化碳会析出有机物W和无机物,写出化学反应方程式:
W是一种常用的抗氧剂,理由是
(4)试写出由煤焦油中可以分离出苯为原料,无机试剂任选,写出由苯合成苯酚的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中(0.65)
解题方法
9. 锌是一种常用金属,冶炼方法有火法和湿法。
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。氮化镓(GaN)是制造LED的重要材料,被誉为第三代半导体材料。
(1)Ga在元素周期表中的位置_____ 。
(2)GaN可由Ga和NH3在高温条件下合成,该反应的化学方程式为_____ 。
(3)下列有关镓和镓的化合物的说法正确的是_____(填字母序号)。
II.工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示,回答下列问题:

已知:Fe的活泼性强于Ni
(4)ZnFe2O4可以写成ZnO·Fe2O3,写出ZnFe2O4与H2SO4反应的化学方程式_______ 。
(5)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,只使Fe3+转化为Fe(OH) 3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是_____ 。
(6)净化II中加入Zn的目的是_____ 。
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。氮化镓(GaN)是制造LED的重要材料,被誉为第三代半导体材料。
(1)Ga在元素周期表中的位置
(2)GaN可由Ga和NH3在高温条件下合成,该反应的化学方程式为
(3)下列有关镓和镓的化合物的说法正确的是_____(填字母序号)。
| A.一定条件下,Ga可溶于盐酸和氢氧化钠 |
| B.常温下,Ga可与水剧烈反应放出氢气 |
| C.Ga2O3可由Ga(OH) 3受热分解得到 |
| D.一定条件下,Ga2O3可与NaOH反应生成盐 |
II.工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示,回答下列问题:

已知:Fe的活泼性强于Ni
(4)ZnFe2O4可以写成ZnO·Fe2O3,写出ZnFe2O4与H2SO4反应的化学方程式
(5)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,只使Fe3+转化为Fe(OH) 3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是
(6)净化II中加入Zn的目的是
【知识点】 胶体 氧化还原反应方程式的配平解读 电冶金解读 同主族元素性质递变规律
您最近一年使用:0次
解答题-原理综合题
|
适中(0.65)
解题方法
10. 已知I、II反应在一定条件节焓变及平衡常数如下:
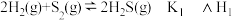 (Ⅰ)
(Ⅰ)
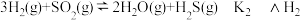 (Ⅱ)
(Ⅱ)
(1)用△Hl、△H2表示反应4H2(g)+2SO2(g) S2(g)+4H2O(g)的△H
S2(g)+4H2O(g)的△H
(2)回答下列反应(Ⅰ)的相关问题:
①温度为T1,在1L恒容容器中加入1.8mol H2、1.2mol S2, 10min时反应达到平衡。测得10min V(H2S)=0.08 mol·L-1·min-l,则该条件下的平衡常数为_____ L·mol-l,若此时再向容器中充H2、S2、H2S各0.8mol,则平衡移动方向为_____ (填“正向”、“逆向”或“不移动”);
②温度为T2时T2>T1),在1L恒容容器中也加入1.8mol H2、1.2mol S2,建立平衡时测得S2的转化率为25%,据此判断△H1_____ 0(填“>”或“<”),与T1时相比,平衡常数K1_____ (填“增大”、“减小”或“不变”);
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是_____ (写出主要反应的离子方程式),该溶液中,[Na+]______ 2[ SO ]+ [HSO
]+ [HSO ](填“>”、“<”或“=”)。
](填“>”、“<”或“=”)。
②在某NaHSO3、Na2SO3混合溶液中HSO 、SO
、SO 物质的量分数随pH变化曲线如图所示(部分):根据图示,求SO
物质的量分数随pH变化曲线如图所示(部分):根据图示,求SO 的水解平衡常数=
的水解平衡常数=______ mol·L-1.

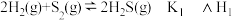 (Ⅰ)
(Ⅰ)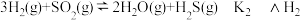 (Ⅱ)
(Ⅱ)(1)用△Hl、△H2表示反应4H2(g)+2SO2(g)
 S2(g)+4H2O(g)的△H
S2(g)+4H2O(g)的△H(2)回答下列反应(Ⅰ)的相关问题:
①温度为T1,在1L恒容容器中加入1.8mol H2、1.2mol S2, 10min时反应达到平衡。测得10min V(H2S)=0.08 mol·L-1·min-l,则该条件下的平衡常数为
②温度为T2时T2>T1),在1L恒容容器中也加入1.8mol H2、1.2mol S2,建立平衡时测得S2的转化率为25%,据此判断△H1
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是
 ]+ [HSO
]+ [HSO ](填“>”、“<”或“=”)。
](填“>”、“<”或“=”)。②在某NaHSO3、Na2SO3混合溶液中HSO
 、SO
、SO 物质的量分数随pH变化曲线如图所示(部分):根据图示,求SO
物质的量分数随pH变化曲线如图所示(部分):根据图示,求SO 的水解平衡常数=
的水解平衡常数=
【知识点】 化学反应热的计算 化学平衡的移动及其影响因素 化学平衡的有关计算 盐类水解规律
您最近一年使用:0次
解答题-实验探究题
|
适中(0.65)
11. 高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:
MnO2熔融氧化:3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O;
3K2MnO4+KCl+3H2O;
K2MnO4的歧化反应:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3。
已知K2MnO4溶液显绿色。请回答下列问题:
(1)MnO2熔融氧化应放在____ 中加热(填仪器编号)。
①烧杯 ②瓷坩埚 ③蒸发皿 ④铁坩埚
(2)在MnO2熔融氧化所得产物的热浸取液中通入CO2气体,使K2MnO4歧化的过程在如图所示装置中进行,A、B、C、D、E为弹簧夹,F、G为气囊,H为带套管的玻璃棒。

①为了能充分利用CO2,装置中使用了两个气囊。当试管内依次加入块状碳酸钙和稀盐酸后,关闭弹簧夹B、E,微开弹簧夹A,打开弹簧夹C、D,往热K2MnO4溶液中通入CO2气体,未反应的CO2被收集到气囊F中。待气囊F中收集到较多气体时,关闭弹簧夹____ ,打开弹簧夹______ ,轻轻挤压气囊F,将CO2气体缓缓地压入K2MnO4溶液中再次反应,未反应的CO2气体被收集在气囊G中。然后将气囊G中的气体挤压入气囊F中,如此反复,直至K2MnO4完全反应。
②检验K2MnO4歧化反应已反应完全的实验操作是____________ 。
(3)将三颈烧瓶中所得产物进行抽滤,将滤液倒入蒸发皿中,蒸发浓缩至____ ,自然冷却结晶,抽滤,得到针状的高锰酸钾晶体。本实验应采用低温烘干的方法来干燥产品,原因是_______ 。
(4)利用氧化还原滴定法进行高锰酸钾纯度分析,原理为2 +5
+5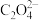 +16H+=2Mn2++10CO2↑+8H2O。
+16H+=2Mn2++10CO2↑+8H2O。
现称取制得的高锰酸钾产品7.245 g,配成500 mL溶液,用移液管量取25.00 mL待测液,用0.100 0 mol·L−1草酸钠标准溶液进行滴定,终点时消耗标准液的体积为50.00 mL(不考虑杂质的反应),则高锰酸钾产品的纯度为____ [保留4位有效数字,已知M(KMnO4)=158 g·mol−1]。若移液管用蒸馏水洗净后没有用待测液润洗,则测定结果将____ (填“偏大”、“偏小”或“不变”)。
MnO2熔融氧化:3MnO2+KClO3+6KOH
 3K2MnO4+KCl+3H2O;
3K2MnO4+KCl+3H2O;K2MnO4的歧化反应:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3。
已知K2MnO4溶液显绿色。请回答下列问题:
(1)MnO2熔融氧化应放在
①烧杯 ②瓷坩埚 ③蒸发皿 ④铁坩埚
(2)在MnO2熔融氧化所得产物的热浸取液中通入CO2气体,使K2MnO4歧化的过程在如图所示装置中进行,A、B、C、D、E为弹簧夹,F、G为气囊,H为带套管的玻璃棒。

①为了能充分利用CO2,装置中使用了两个气囊。当试管内依次加入块状碳酸钙和稀盐酸后,关闭弹簧夹B、E,微开弹簧夹A,打开弹簧夹C、D,往热K2MnO4溶液中通入CO2气体,未反应的CO2被收集到气囊F中。待气囊F中收集到较多气体时,关闭弹簧夹
②检验K2MnO4歧化反应已反应完全的实验操作是
(3)将三颈烧瓶中所得产物进行抽滤,将滤液倒入蒸发皿中,蒸发浓缩至
(4)利用氧化还原滴定法进行高锰酸钾纯度分析,原理为2
 +5
+5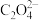 +16H+=2Mn2++10CO2↑+8H2O。
+16H+=2Mn2++10CO2↑+8H2O。现称取制得的高锰酸钾产品7.245 g,配成500 mL溶液,用移液管量取25.00 mL待测液,用0.100 0 mol·L−1草酸钠标准溶液进行滴定,终点时消耗标准液的体积为50.00 mL(不考虑杂质的反应),则高锰酸钾产品的纯度为
您最近一年使用:0次
2018-08-09更新
|
159次组卷
|
7卷引用:2015届浙江省台州市路桥区高三高考模拟三理综化学试卷
2015届浙江省台州市路桥区高三高考模拟三理综化学试卷2016届湖北省黄石市高三9月调研考试化学试卷(已下线)2018年5月29日 押高考化学第26题(2)——《每日一题》2018年高三化学四轮复习(已下线)解密18 物质的制备、实验方案的设计与评价——备战2018年高考化学之高频考点解密(已下线)2018年11月25日 《每日一题》 人教版一轮复习-每周一测(已下线)2019年11月24日《每日一题》2020年高考化学一轮复习—— 每周一测(已下线)【南昌新东方】莲塘一中2020届高三12月质量检测
试卷分析
整体难度:适中
考查范围:化学反应原理、常见无机物及其应用、物质结构与性质、化学实验基础、有机化学基础、认识化学科学
试卷题型(共 11题)
题型
数量
单选题
7
解答题
4
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.64 | 金属的电化学腐蚀与防护 | |
| 2 | 0.65 | 焰色试验 同周期元素性质递变规律理解及应用 化学实验基础操作 化学实验方案的设计与评价 | |
| 3 | 0.65 | 元素周期律、元素周期表的推断 元素非金属性强弱的比较方法 微粒半径大小的比较方法 共价键 | |
| 4 | 0.85 | 烷烃的命名 有机官能团的性质及结构 同系物 利用烃完全燃烧耗氧量的规律进行的计算 | |
| 5 | 0.65 | 原电池 电解原理的理解及判断 原电池、电解池综合考查 利用电子守恒法进行多池串联相关计算 | |
| 6 | 0.65 | 溶液的酸碱性与pH 溶液pH的计算 电离平衡常数及影响因素 盐溶液中离子浓度大小的比较 | |
| 7 | 0.65 | 离子共存 离子反应在化合物组成的分析、鉴定的应用 离子的检验 | |
| 二、解答题 | |||
| 8 | 0.65 | 卤代烃的性质 酚类的化学性质 根据题给物质选择合适合成路线 有机推断综合考查 | 有机推断题 |
| 9 | 0.65 | 胶体 氧化还原反应方程式的配平 电冶金 同主族元素性质递变规律 | 工业流程题 |
| 10 | 0.65 | 化学反应热的计算 化学平衡的移动及其影响因素 化学平衡的有关计算 盐类水解规律 | 原理综合题 |
| 11 | 0.65 | 酸碱中和滴定原理的应用 常见无机物的制备 物质制备的探究 综合实验设计与评价 | 实验探究题 |



