名校
解题方法
1 . 粗铜中一般含有锌、铁、银、金等杂质。在如图所示的装置中,甲池的总反应方程式为2CH3OH+3O2+4KOH=2K2CO3+6H2O。接通电路一段时间后,精Cu电极质量增加了3.2 g。在此过程中,下列说法正确的是
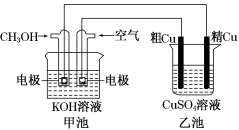
| A.乙池中CuSO4溶液的浓度减小 |
| B.甲池中理论上消耗标准状况下空气的体积是2.8 L(空气中O2体积分数以20%计算) |
| C.甲池是电能转化为化学能的装置,乙池是化学能转化为电能的装置 |
D.甲池通入CH3OH一极的电极反应为CH3OH-6e-+2H2O=CO +8H+ +8H+ |
您最近一年使用:0次
2022-12-11更新
|
233次组卷
|
3卷引用:江西省南昌十九中2022-2023学年高二上学期期末考试化学试卷
名校
2 . 国家能源局发布2021年前三季度全国光伏发电建设运行情况,前三季度新增并网容量2555.6万千瓦,下列如图为光伏并网发电装置,左图甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成[(CH3)4NOH],其工作原理如图所示,下列叙述中不正确的是


| A.光伏并网发电装置是利用原电池原理,图中N型半导体为负极,P型半导体为正极 |
| B.a极电极反应式:2(CH3)4N++2H2O+2e-=2(CH3)4NOH+H2↑ |
| C.制备18.2g(CH3)4NOH,两极共产生4.48L气体(标准状况) |
| D.c、e为阳离子交换膜,d均为阴离子交换膜 |
您最近一年使用:0次
名校
解题方法
3 . 无膜氯液流电池是一种先进的低成本高储能电池,可广泛应用于再生能源储能和智能电网的备用电源等,电池工作原理如图所示:
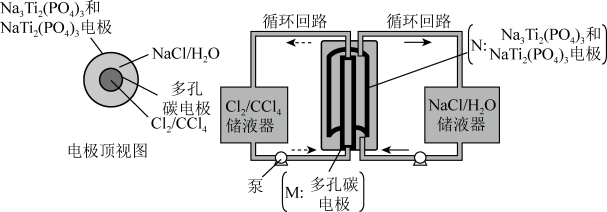
下列说法错误的是

下列说法错误的是
| A.充电时,N极的电极反应式为:Na3Ti2(PO4)3-2e-=NaTi2(PO4)3+2Na+ |
| B.放电时,M极为正极 |
| C.放电时,右侧储液器中NaCl的浓度增大 |
| D.充电时,电路中每转移1mole-,N电极理论上质量增加23g |
您最近一年使用:0次
2022-07-20更新
|
284次组卷
|
2卷引用:江西省南昌市八一中学2022届高三下学期第三次模拟考试理科综合化学试题
名校
4 . 以铜作催化剂的一种铝硫电池的示意图如图所示,电池放电时的反应原理为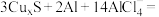
 。下列说法错误的是(阳离子交换膜只允许阳离子通过)
。下列说法错误的是(阳离子交换膜只允许阳离子通过)
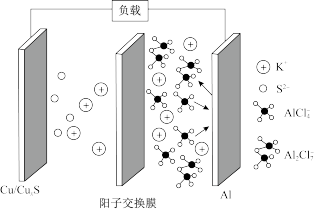
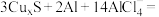
 。下列说法错误的是(阳离子交换膜只允许阳离子通过)
。下列说法错误的是(阳离子交换膜只允许阳离子通过)
| A.充电时,Cu/CuxS电极为阳极 |
B.充电时,阳极区的电极反应式为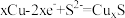 |
| C.放电时,K+通过阳离子交换膜向Cu/CuxS电极移动 |
| D.放电时,每转移1mol电子,负极区电解质溶液质量减轻30g |
您最近一年使用:0次
2022-05-23更新
|
988次组卷
|
3卷引用:江西省南昌市三校(一中、十中、铁一中)2022-2023学年高三上学期11月期中联考化学试题
江西省南昌市三校(一中、十中、铁一中)2022-2023学年高三上学期11月期中联考化学试题湖南省长沙市第一中学2022届高三第一次模拟化学试题(已下线)专题08 电化学及其应用-2022年高考真题模拟题分项汇编
名校
解题方法
5 . 某科研小组在研究硅氧材料的电化学性能时,将硅氧材料作为正极,金属锂作为负极,非水体系的LiPF6作为电解液,起到在正、负极间传递Li+的作用,且充、放电时电解液所含的物质种类不发生变化。电池放电时的总反应为5SiO2+(4+x)Li=2Li2Si2O5+LixSi。下列说法中错误的是
| A.硅氧材料导电性差,可与石墨形成复合物以增强电极的导电性 |
| B.电池充电时,电解液中的Li+向锂电极移动 |
| C.放电时的正极反应为5SiO2+(4+x)Li++(4+x)e-=2Li2Si2O5+LixSi |
D.电池充电时,外电路转移lmol电子,则硅氧材料的质量增重 g g |
您最近一年使用:0次
2022-03-07更新
|
424次组卷
|
4卷引用:江西省南昌市第十中学2021-2022学年高三下学期第一次月考理科综合化学试题
名校
解题方法
6 . H2S可通过电化学循环法转化为H2SO4和H2,其装置如图所示。下列分析错误的是

已知氧化过程发生两步反应:H2S+H2SO4=S+SO2+2H2O,S+O2=SO2。

已知氧化过程发生两步反应:H2S+H2SO4=S+SO2+2H2O,S+O2=SO2。
| A.电极a周围溶液pH减小 |
| B.电流由电极b经负载、电极a、离子导体回到电极b |
| C.理论上1molH2S参加反应可产生1mol H2 |
| D.用此电池为铅蓄电池充电,该电池生成19.6g H2SO4时,铅蓄电池消耗7.2g水 |
您最近一年使用:0次
2021-11-24更新
|
780次组卷
|
8卷引用:江西省南昌市外国语学校2021-2022学年高二上学期期末考试 化学(理科)试题
江西省南昌市外国语学校2021-2022学年高二上学期期末考试 化学(理科)试题(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)一轮巩固卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(辽宁专用)(已下线)一轮巩固卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(湖北专用)(已下线)专题12 化学反应与电能-2023年高考化学一轮复习小题多维练(全国通用)(已下线)专题12 化学反应与电能-2023年高考化学一轮复习小题多维练(全国通用)山东省青岛市2021-2022学年高三上学期期中教学质量检测化学试题宁夏石嘴山市第三中学2021-2022学年高三上学期第二次月考化学试题
名校
7 . LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠。已知该电池放电时的电极反应式为:正极FePO4+Li+ +e-=LiFePO4负极Li-e- =Li+,下列说法中正确的是
| A.充电时电池反应为FePO4 + Li = LiFePO4 |
| B.充电时动力电池上标注“+”的电极应与外接电源的正极相连 |
| C.放电时电池内部Li+向正极移动 |
| D.放电时,在正极上是Li+得电子被还原 |
您最近一年使用:0次
2021-08-12更新
|
496次组卷
|
3卷引用:江西省南昌十九中2022-2023学年高二上学期期末考试化学试卷
名校
8 . 二甲醚(CH3OCH3)被称为 21 世纪的新型燃料,它清洁、高效、具有优良的环保性能,二甲醚是种无色气体,具有轻微的醚香味,二甲醚可作燃料电池的燃料。
(1)以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。请写出该电池中负极上的电极反应式是:___________ 。
(2)用(1)中的燃料电池为电源,以石墨为电极电解500mLNaCl溶液,装置如图甲所示。

①请写出电解过程中总反应的离子方程式___________ 。
②当燃料电池消耗 2.8 LO2 (标准状况下)时,计算此时:NaCl 溶液中c(OH-)=___________ mol/L (假设溶液的体积不变,气体全部从溶液中逸出)。
③短暂电解之后,要使溶液恢复原状,应该向溶液中加入物质___________ (填名称)。
(3)用(1)中的燃料电池为电源,用离子交换膜控制电解液中c(OH-)制备纳米Cu2O,其装置如图乙所示。
①上述装置中 D电极应连接二甲醚燃料电池的___________ (填“正极”或“负极”),该电解池中离子交换膜为___________ 离子交换膜(填“阴”或“阳”)。
②该电解池的阳极反应式为___________ 。
(1)以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。请写出该电池中负极上的电极反应式是:
(2)用(1)中的燃料电池为电源,以石墨为电极电解500mLNaCl溶液,装置如图甲所示。

①请写出电解过程中总反应的离子方程式
②当燃料电池消耗 2.8 LO2 (标准状况下)时,计算此时:NaCl 溶液中c(OH-)=
③短暂电解之后,要使溶液恢复原状,应该向溶液中加入物质
(3)用(1)中的燃料电池为电源,用离子交换膜控制电解液中c(OH-)制备纳米Cu2O,其装置如图乙所示。
①上述装置中 D电极应连接二甲醚燃料电池的
②该电解池的阳极反应式为
您最近一年使用:0次
2021-02-05更新
|
357次组卷
|
3卷引用:江西省师范大学附属中学2021-2022学年高二上学期期末化学试题
9 . 下列有关电化学装置完全正确的是
 | 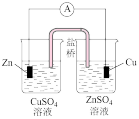 | 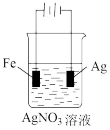 | 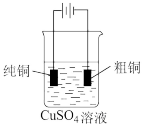 |
| A.防止Fe被腐蚀 | B.设计铜锌原电池 | C.铁上镀银 | D.铜的精炼 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-02-05更新
|
310次组卷
|
3卷引用:江西省师范大学附属中学2021-2022学年高二上学期期末化学试题
名校
10 . 如图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽。接通电路后(此时开关处于打开状态)发现
为电镀槽。接通电路后(此时开关处于打开状态)发现 上的c点显红色。接通
上的c点显红色。接通 使c、d两点短路后,可以实现铁上镀锌。下列叙述正确的是
使c、d两点短路后,可以实现铁上镀锌。下列叙述正确的是
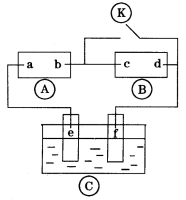
 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽。接通电路后(此时开关处于打开状态)发现
为电镀槽。接通电路后(此时开关处于打开状态)发现 上的c点显红色。接通
上的c点显红色。接通 使c、d两点短路后,可以实现铁上镀锌。下列叙述正确的是
使c、d两点短路后,可以实现铁上镀锌。下列叙述正确的是
| A.a为直流电源的负极 |
| B.c极发生的反应为2H2O+2e-=H2↑+2OH- |
| C.f电极为锌板 |
| D.e极发生还原反应 |
您最近一年使用:0次
2021-02-05更新
|
200次组卷
|
2卷引用:江西省师范大学附属中学2021-2022学年高二上学期期末化学试题



