11-12高三上·山东聊城·期中
1 . W、X、Y、Z是原子序数逐渐增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1) X的原子结构示意图为____________ 。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为______________ 。
(3) W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的化学方程式为_________________________________________ 。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为_______________________ 。
(5)比较Y、Z气态氢化物的稳定性_________ >_______ (用分子式表示)
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:_____ >_____ >______ >______ 。(用“离子符号”表示)
(1) X的原子结构示意图为
(2)W与Y 可形成化合物W2Y,该化合物的电子式为
(3) W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的化学方程式为
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为
(5)比较Y、Z气态氢化物的稳定性
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:
您最近一年使用:0次
11-12高三上·湖北武汉·阶段练习
2 . 下表为元素周期表的一部分,请参照元素①一⑩在周期表中的位置,用元素符号或化学式回答下列问题。
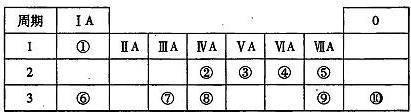
(1)⑤、⑥、⑦的原子半径由大到小的顺序___________ 。
(2)②、③、⑧的最高价含氧酸的酸性由强到弱的顺序是_____________ 。
(3)①、④、⑥、⑨中的某些元素可以形成既含有离子键又含有共价键的化合物,写出其中两种不同类别物质的化学式_________ 、___________ 。
(4)上表中所列出的部分元素能形成多种带有18个电子的分子,请写出其中三种的化学式
_____________ 。

(1)⑤、⑥、⑦的原子半径由大到小的顺序
(2)②、③、⑧的最高价含氧酸的酸性由强到弱的顺序是
(3)①、④、⑥、⑨中的某些元素可以形成既含有离子键又含有共价键的化合物,写出其中两种不同类别物质的化学式
(4)上表中所列出的部分元素能形成多种带有18个电子的分子,请写出其中三种的化学式
您最近一年使用:0次
11-12高三上·浙江宁波·期中
3 . 下表为部分短周期元素化合价及相应氢化物沸点的数据:
已知:①A与D可形成化合物AD2、AD3,可用于制备强酸甲;
②B与D可形成化合物BD、BD2,可用于制备强酸乙。
请回答:
(1)表中属于第三周期元素的是_________________________ (用表中元素编号填写)。
(2)写出H的最高价氧化物的电子式:__________________________ ;
比较A、D、G三种简单阴离子的半径大小:r( ) >r( ) >r( ) (均用实际的元素符号表示)。
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________________ 。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是:______________________ 。
元素性质 | 元素编号 | |||||||
A | B | C | D | E | F | G | H | |
氢化物的沸点(℃) | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
最高化合价 | +6 | +5 | +4 | +5 | +7 | +4 | ||
最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
已知:①A与D可形成化合物AD2、AD3,可用于制备强酸甲;
②B与D可形成化合物BD、BD2,可用于制备强酸乙。
请回答:
(1)表中属于第三周期元素的是
(2)写出H的最高价氧化物的电子式:
比较A、D、G三种简单阴离子的半径大小:r
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是:
您最近一年使用:0次
10-11高一下·海南·期末
4 . 四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
请回答下列问题:
(1)元素Z位于周期表中第_______ 周期,_______ 族;
(2)这些元素的氢化物中,水溶液碱性最强的是_____________ (写化学式);
(3)XW2的电子式为________________________ ;
(4)Y的最高价氧化物的化学式为_________________ 。
| X | Y | |
| Z | W |
请回答下列问题:
(1)元素Z位于周期表中第
(2)这些元素的氢化物中,水溶液碱性最强的是
(3)XW2的电子式为
(4)Y的最高价氧化物的化学式为
您最近一年使用:0次
2011-07-27更新
|
956次组卷
|
5卷引用:2015届陕西省宝鸡市岐山县高三上学期期中考试化学试卷
(已下线)2015届陕西省宝鸡市岐山县高三上学期期中考试化学试卷(已下线)2010—2011学年海南中学高一第二学期期末考试(2-20班)化学试卷(已下线)2013-2014学年海南省海南中学第二学期高一期末考试化学试卷2014-2015河南省南阳方城一中高一下学期学期第一次月考化学试卷甘肃省玉门一中2018-2019学年高一下学期期末考试化学试题
10-11高三·河北衡水·阶段练习
5 . 下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语作答:
(1)④、⑤、⑦的原子半径由大到小的顺序为____________ 。
(2)⑥和⑦的最高价含氧酸的酸性强弱为_________________ 。
(3)由表中元素形成的物质可发生下图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
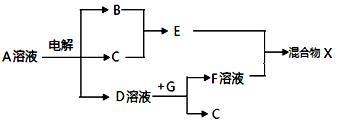
①写出电解A溶液的化学方程式______________________________________ 。
②若上图中各步反应均为完全转化,则混合物X中含有的物质有____________ 。
(4)砷(As)的化合物可用于杀虫及医疗。
①As的原子结构示意图为___________ ,②其氢化物的化学式为____________ 。
③Y由②⑤⑦三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为___________________ 。
I A | 0 | ||||||
① | II A | III A | IV A | V A | VI A | VII A | |
② | ④ | ||||||
⑤ | ③ | ⑧ | ⑥ | ⑦ |
(1)④、⑤、⑦的原子半径由大到小的顺序为
(2)⑥和⑦的最高价含氧酸的酸性强弱为
(3)由表中元素形成的物质可发生下图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。

①写出电解A溶液的化学方程式
②若上图中各步反应均为完全转化,则混合物X中含有的物质有
(4)砷(As)的化合物可用于杀虫及医疗。
①As的原子结构示意图为
③Y由②⑤⑦三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为
您最近一年使用:0次
10-11高三上·北京·阶段练习
6 . 元素在周期表中的位置,反映了元素的原子结构和元素的性质,右图是元素周期表的一部分。
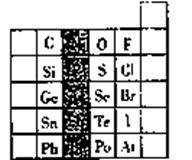
(1)阴影部分元素在元素周期表中的位置为第_________ 族。根据元素周期律、预测;酸性强弱H3AsO4______ H3PO4(用“>”或“<”表示)
(2)元素S的最高正价和最低负价的代数和为________ ,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度)。请判断:在相同条件下Se与H2反应的限度比S与H2反应限度____________ 。(选填“更大”、“更小”或“相同”)
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是__________
(4)下列说法正确的是__________
A.C、N、O、F的原子半径随着原子数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱

(1)阴影部分元素在元素周期表中的位置为第
(2)元素S的最高正价和最低负价的代数和为
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是
(4)下列说法正确的是
A.C、N、O、F的原子半径随着原子数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
您最近一年使用:0次



