1 . A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两种元素有以下叙述:①原子半径A<B ②离子半径A>B ③原子序数A>B ④原子最外层电子数A>B ⑤A的正价与B的负价绝对值不一定相等,其中正确的是
| A.①② | B.③④⑤ | C.③⑤ | D.③④ |
您最近一年使用:0次
2016-07-07更新
|
131次组卷
|
4卷引用:2014-2015山东省乐陵市第一中学高一下学期期中化学试卷
2 . X、Y是周期表中的两种元素,X原子的半径比Y的半径小,且具有相同的电子层数,(选项中m、n均为正整数)下列有关叙述正确的是
| A.若X、Y原子序数相差l,Y为IIA族,则X一定是IIIA族 |
| B.若Y(OH)m易溶于水,则X(OH)n一定不溶于水 |
| C.若HnXOm为强酸,则x的氢化物溶液于水一定显酸性 |
| D.若Y元素形成的单质是气体,则X元素形成的单质一定也是气体 |
您最近一年使用:0次
2016-06-24更新
|
360次组卷
|
4卷引用:2015-2016学年湖北黄冈中学高一下期中化学试卷
9-10高一下·福建三明·期中
名校
3 . A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是
| A.A、B、C、D、E | B.E、C、D、B、A |
| C.B、A、D、C、E | D.C、D、A、B、E |
您最近一年使用:0次
2016-05-04更新
|
533次组卷
|
31卷引用:2010年山西省忻州市高一下学期期末联考化学(A类)试题
(已下线)2010年山西省忻州市高一下学期期末联考化学(A类)试题(已下线)2012届天津市滨海新区大港一中高三上学期第二次月考化学试卷2014-2015陕西省三原北城中学高一下学期第一次月考化学试卷2016-2017学年湖南省长沙明德中学高二上开学测化学试卷河北省定州市第二中学2016-2017学年高一4月月考化学试题山西省忻州市第一中学2016-2017学年高一必修二:第一章 同周期同主族元素性质的递变同步检测化学试题高中化学人教版 必修2 第一章 物质结构 元素周期律 第二节 元素周期律 元素周期律河南省鹤壁市淇滨高级中学2017-2018学年高一3月月考化学试题河南省周口中英文学校2017-2018学年高一下期第一次月考化学试题安徽省六安市舒城中学2017-2018学年高一下学期第二次统考化学试题山东省菏泽市第一中学2017-2018学年高一自主检测化学试题山西省忻州二中2017-2018学年高一下学期期中考试化学试题山西省临汾第一中学2017-2018学年高一下学期第一次月考化学试题福建省罗源市第一中学2018-2019学年高二下学期3月月考化学试题山东省单县第一中学2018-2019学年高一下学期第三阶段考试化学试题山西省运城市临猗县临晋中学2019-2020学年高一下学期开学复课摸底考试化学试题河南省新乡市辉县市第二高级中学2019-2020学年高一下学期第一次月考化学试题(B部)湖北省黄冈市黄梅国际育才高级中学2018-2019学年高一下学期3月月考化学试题鲁科版(2019)高一必修第二册 第1章 原子结构 元素周期律第3节 元素周期表的应用 教材帮内蒙古包头市第一中学2016-2017学年高一下学期期中考试化学试题1(已下线)题型77 基于物质性质考查元素周期律(已下线)09~10学年三明市五校高一下学期期中联考化学卷(已下线)2011-2012学年山东省济宁汶上一中高一下学期3月月考化学试卷(已下线)2011-2012学年安徽省蚌埠二中高一下学期期中考试化学试卷(已下线)2012-2013学年浙江省宁海县正学中学高一下学期第一次阶段性测试化学试卷2014-2015学年新疆兵团农二师华山中学高二(上)开学化学试卷2015-2016学年甘肃省武威二中高一下学期第一次月考化学试卷云南省沾益县第一中学2016-2017学年高一下学期第一次月考化学试题甘肃省民勤县第一中学2020-2021学年高一下学期 第一次月考化学(理)试题宁夏青铜峡市高级中学2020-2021学年高一下学期第一次月考化学试题福建省宁化第六中学2021-2022学年高一下学期第一次月考化学试题
名校
4 . W、X、Y、Z四种短周期元素在周期表中的位置如图所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物。
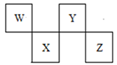

请回答下列问题。
(1)H2Y2的电子式为___________ ,Z在周期表中的位置___________ 。
(2)在图中,b的pH约为7,且含有Fe2+和淀粉KI的水溶液,a为H2Y2的水溶液,旋开分液漏斗旋钮,观察到烧瓶中溶液呈蓝色并有红褐色沉淀生成。当消耗2molI-时,共转移3mol电子,该反应的离子方程式是_________________________ 。
(3)已知:298K时,金属钠与Y2气体反应,若生成1molNa2Y固体时,放出热量414kJ;若生成1molNa2Y2固体时,放出热量511kJ。则由Na2Y固体与Y2气体反应生成Na2Y2固体的热化学方程式为_____________ 。
(4)有人设想利用原电池原理以气体Z2和氢气制备一种重要的化工原料,同时获取电能。假设这种想法可行,用石墨作电极材料,用稀盐酸作电解溶液,则通入Z2的电极为原电池的___________ 极,其电极反应式为____________________ 。


请回答下列问题。
(1)H2Y2的电子式为
(2)在图中,b的pH约为7,且含有Fe2+和淀粉KI的水溶液,a为H2Y2的水溶液,旋开分液漏斗旋钮,观察到烧瓶中溶液呈蓝色并有红褐色沉淀生成。当消耗2molI-时,共转移3mol电子,该反应的离子方程式是
(3)已知:298K时,金属钠与Y2气体反应,若生成1molNa2Y固体时,放出热量414kJ;若生成1molNa2Y2固体时,放出热量511kJ。则由Na2Y固体与Y2气体反应生成Na2Y2固体的热化学方程式为
(4)有人设想利用原电池原理以气体Z2和氢气制备一种重要的化工原料,同时获取电能。假设这种想法可行,用石墨作电极材料,用稀盐酸作电解溶液,则通入Z2的电极为原电池的
您最近一年使用:0次
2015-11-12更新
|
772次组卷
|
4卷引用:2016届河北省衡水中学高三上学期四调考试化学试卷
2016届河北省衡水中学高三上学期四调考试化学试卷2015-2016学年浙江省杭州市五校联盟高三12月月考化学试卷河北省衡水中学2020届高三七调考试化学试题(已下线)考点05 元素周期表和元素周期律-2020年高考化学命题预测与模拟试题分类精编
13-14高一下·湖北黄石·期中
名校
5 . 如图为周期表中短周期的一部分,若X原子最外层电 子数比次外层电子数少3,则下列说法正确的是
| R | ||
| X | Y | Z |
| A.X的氢化物比 R的氢化物稳定 |
| B.原子半径大小顺序是 Z>Y>X>R |
| C.Z的单质能与Y的某些化合物发生置换反应 |
| D.X、Z可形成化合物XZ5,分子中各原子均满足最外层8电子结构 |
您最近一年使用:0次
2014-08-25更新
|
393次组卷
|
4卷引用:福建省福州市闽侯县2016-2017学年高二下学期期末考试化学试题
福建省福州市闽侯县2016-2017学年高二下学期期末考试化学试题人教版2017-2018学年高一化学必修2:第一章 第二节 难度偏大尖子生题新疆吾尔自治区乌鲁木齐市第七十中学2021届高三上学期第一次月考(9月)化学试题(已下线)2013-2014湖北省黄石市三中高一下学期期中考试化学试卷
2014高三·全国·专题练习
解题方法
6 . A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。
请回答下列问题:
(1)元素D在周期表中的位置___ 。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)___ 。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有___ 。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:______________ 。
若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:______________ 。
(5)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的离子方程式______________ 。
请回答下列问题:
(1)元素D在周期表中的位置
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:
若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:
(5)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的离子方程式
您最近一年使用:0次
10-11高一下·陕西西安·阶段练习
7 . 0.2 molX元素的离子被还原成中性原子时,需要得到2.408×1023个电子,0.3gX的单质与足量盐酸反应放出0.015g氢气;X的中子数和质子数相等;Y的原子半径是其所在周期元素中最小的,它的阴离子结构与氩原子结构相同。
(1)计算X的相对原子质量(写出计算过程)______
(2)推断X、Y两元素在周期表中的位置。______
(3)用化学方程式表示X最高价氧化物对应的水化物与Y单质的反应。______
(1)计算X的相对原子质量(写出计算过程)
(2)推断X、Y两元素在周期表中的位置。
(3)用化学方程式表示X最高价氧化物对应的水化物与Y单质的反应。
您最近一年使用:0次
9-10高一下·辽宁·期中
名校
8 . 几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是
| 元素代号 | L | M | X | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
下列叙述正确的是
| A.离子半径大小:r(M3+)>r(T2-) |
| B.R的氧化物对应的水化物可能具有两性 |
| C.X单质在氧气中燃烧生成XO3 |
| D.L、X形成的简单离子核外电子数相等 |
您最近一年使用:0次
2010-05-15更新
|
696次组卷
|
13卷引用:2010年辽宁省师大附中高一下学期期中考试
(已下线)2010年辽宁省师大附中高一下学期期中考试(已下线)09~10学年江苏宿迁中学高一下学期期中考试化学卷2015-2016学年河北省邢台一中高一下第一次月考化学试卷2020届高三化学选修三二轮专题复习——对角线规则人教版高一化学必修2同步练习:第一章第二节第二课时《元素周期律的应用》(已下线)专题5 微观结构与物质的多样性 综合评价(1)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)河北省石家庄市第二十三中学2021-2022学年高二下学期期中考试化学试题河南省郑州市第一中学2022-2023学年高一下学期期中考试化学试题2015-2016学年吉林省松原油田高中高一下期初考试化学卷2017届江西省赣州市十四校高三上期中联考化学试卷2017届江西省赣州市十三县(市)高三上期中化学试卷山东省临朐县实验中学2020年高一下学期第一次月结学情考试化学试题安徽省蚌埠三中2020-2021学年高一下学期4月月考化学试题
9-10高一下·黑龙江·阶段练习
9 . 某二价金属的同位素的碳酸盐(MCO3)粉末4g,放到50mL 1mol/L的稀硫酸中,有无色略带酸味的气体缓慢生成,同时生成新的不溶物。向滤液中加入60mL 1mol/L得氢氧化钠溶液后,溶液的pH=7,求这种同位素的质量数;若其原子核内的中子数为质子数的1.5倍。
通过计算确定
(1)该同位素原子核内的质子数和中子数并写出该原子组成符号
(2)该元素在周期表中的位置
通过计算确定
(1)该同位素原子核内的质子数和中子数并写出该原子组成符号
(2)该元素在周期表中的位置
您最近一年使用:0次
2010·江西·三模
解题方法
10 . A、B、C、D、E五种短周期元素,原子序数依次递增,A原子形成的阳离子是一个质子,B原子的最外层电子数是次外层的2倍,C原子的最外层电子数与B原子的核外电子总数相等,D在同周期元素中原子半径最大,而E在同周期元素中原子半径最小。A、C、D三种元素可形成化合物甲,B、C、D三种元素可形成化合物乙,甲和乙均为中学化学常见物质。请回答:
(1)甲的电子式为_____________ ,其中所含化学键类型为________________ 。
(2)A的单质与C的单质在碱性条件下构成燃料电池,其正极反应式为__________ ;负极反应式___________ 为。
(3)常温下,甲与乙的水溶液pH均为9,这两种溶液中由水电离出的OH—的物质的量浓度c(OH—)甲:c(OH—)乙=______________ .
(4)A与C、D与C可形成化合物A2C、A2C2、D2C、D2C2,说出的一种用途_________ ;
写出A2C2与E的单质反应的化学方程式____________ 。
(5)浓氨水与固体甲混合,可用于快速制取少量氨气,其原因是___________________________________________________ (请用必要的方程式和简要的文字加以说明)。
(1)甲的电子式为
(2)A的单质与C的单质在碱性条件下构成燃料电池,其正极反应式为
(3)常温下,甲与乙的水溶液pH均为9,这两种溶液中由水电离出的OH—的物质的量浓度c(OH—)甲:c(OH—)乙=
(4)A与C、D与C可形成化合物A2C、A2C2、D2C、D2C2,说出的一种用途
写出A2C2与E的单质反应的化学方程式
(5)浓氨水与固体甲混合,可用于快速制取少量氨气,其原因是
您最近一年使用:0次



