名校
1 . 随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
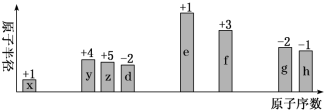
根据判断出的元素回答问题:
上述元素可组成盐R:zx4f(gd4)2。向盛有10mL 1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下:
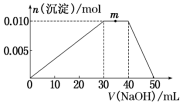
(1)R溶液中,离子浓度由大到小的顺序是___________________________________
(2)写出m点反应的离子方程式:__________________________________________ 。
(3)若在R溶液中改加20mL 1.2mol·L-1 Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为________ mol。

根据判断出的元素回答问题:
上述元素可组成盐R:zx4f(gd4)2。向盛有10mL 1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下:

(1)R溶液中,离子浓度由大到小的顺序是
(2)写出m点反应的离子方程式:
(3)若在R溶液中改加20mL 1.2mol·L-1 Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为
您最近一年使用:0次
2018-09-24更新
|
250次组卷
|
4卷引用:安徽省阜阳市临泉县第一中学2019届高三上学期第三次模拟(12月)化学试题
2 . 已知A、B、C、D、E为原子序数依次增大的五种短周期元素,A与B形成的共价化合物M的水溶液呈碱性,C原子的最内电子数是最外层电子数的2倍,D是同周期中单核离子半径最小的元素,E元素的最高正价与最低负价的代数和为6。请回答下列问题:
(1)化合物M的电子式为_________
(2)B、C所形成的简单离子中,半径较大的是________ 用离子符号表示)。
(3)E的单质与A的简单氧化物反应的离子方程式为________
(4)A、D形成的化合物DA3与水反应生成无色气体,则该反应的化学方程式为________ ,每生成1mol气体转移的电子数为_________ 。
(5)工业上,将CEO3与Na2SO3溶液混合,再加入转H2SO4制备净水剂EO2,则该反应的离子方程式为__________
(6)COA的水溶液和AE溶液反应,生成0.5mol水时放出的热量为28.65kJ,则该反应的热化学方程式为_________
(1)化合物M的电子式为
(2)B、C所形成的简单离子中,半径较大的是
(3)E的单质与A的简单氧化物反应的离子方程式为
(4)A、D形成的化合物DA3与水反应生成无色气体,则该反应的化学方程式为
(5)工业上,将CEO3与Na2SO3溶液混合,再加入转H2SO4制备净水剂EO2,则该反应的离子方程式为
(6)COA的水溶液和AE溶液反应,生成0.5mol水时放出的热量为28.65kJ,则该反应的热化学方程式为
您最近一年使用:0次
2010·安徽合肥·三模
3 . 以下是一些元素的信息,其中有一种元素不在短周期。根据信息完成问题:
(1)写出A元素基态原子的核外电子排布式____________________________________ 。
(2)B、C、X的简单离子半径由大到小的顺序为_______ (用元素离子符号表示)。
(3)化合物YZ4B化学键的类型是____________________________ ,检验该固体化合 物中阳离子的实验的方法和现象是______________________________ 。
(4)A元素的单质在潮湿空气中锈蚀生成绿色物质,用一个化学方程式表示锈蚀过程____________________________________ 。
(5)常温下,工业上用惰性电极在电解槽中电解100 L 1.5 mol·L-1 CB的水溶液时,两极共收集到气体22.4 L(标准状况下),计算电解后阴极区溶液的pH=________ (假设电解前后溶液体积不变)。
| 元素A | 元素B | 元素C | 元素X | 元素Y | 元素Z |
| 单质是一种常见金属,与元素X形成黑色和砖红色两种化合物 | 单质是一种黄绿色气体 | 短周期中金属性最强,与X反应能生成两种化合物 | 最外层电子数是内层电子数的3倍,能形成双原子阴离子 | 单质为双原子分子,结构中 键与 键与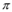 键数目比为1:2 键数目比为1:2 | 阳离子就是一个质子 |
(1)写出A元素基态原子的核外电子排布式
(2)B、C、X的简单离子半径由大到小的顺序为
(3)化合物YZ4B化学键的类型是
(4)A元素的单质在潮湿空气中锈蚀生成绿色物质,用一个化学方程式表示锈蚀过程
(5)常温下,工业上用惰性电极在电解槽中电解100 L 1.5 mol·L-1 CB的水溶液时,两极共收集到气体22.4 L(标准状况下),计算电解后阴极区溶液的pH=
您最近一年使用:0次
2010·安徽安庆·一模
4 . 现有A─E五种元素,其中C、D、E三种是短周期元素。A、B的单质均为生活中常见的金属,A的两种黑色氧化物(其中一种有磁性)的相对分子质量相差160,B的相对原子质量比A大8。C是金属元素,其原子的M层有一个未成对的p电子;D元素的主族序数是其所在周期序数的3倍;E的某种原子的原子核内没有中子。
(1)请写出A在元素周期表中的位置__________ ;写出C的核外电子排布式_________ ;D和E按1:1的原子个数比形成的化合物中含有的化学键为______ (填“极性键”、“非极性键”或“极性键和非极性键”)。
(2)①写出C单质与强碱溶液反应的离子方程式是__________________ 。
②在高温条件下,将D、E组成的气态化合物与A 的粉末充分反应,生成8g E的单质和相应的固态化合物时,放出akJ热量,此反应的热化学方程式是______________ 。
③A的某种氯化物溶液呈黄色,它与B的单质的反应工业上常用于腐蚀电路板,请写出反应的离子方程式____________________________ 。
(1)请写出A在元素周期表中的位置
(2)①写出C单质与强碱溶液反应的离子方程式是
②在高温条件下,将D、E组成的气态化合物与A 的粉末充分反应,生成8g E的单质和相应的固态化合物时,放出akJ热量,此反应的热化学方程式是
③A的某种氯化物溶液呈黄色,它与B的单质的反应工业上常用于腐蚀电路板,请写出反应的离子方程式
您最近一年使用:0次



