1 . CaCN2曾经直接用作肥料。在自然界中,它与水反应产生肥料,在此过程中会涉及到下面一些步骤:
第一步水解,CaCN2与H2O以1:1(物质的量比)反应,生成两种中间体A和B,它们都是含钙的离子化合物,这步反应可以描述为简单的酸碱反应。化合物A和B在热力学上不稳定,受热很容易分解。
化合物A热分解生成离子化合物C和共价化合物D,A与CO2反应,生成共价化合物D和新的离子化合物E。E热分解得到化合物C和CO2。化合物B与CO2、H2O反应生成E和新的共价化合物F,F简单水解(以1:1物质的量比),产生共价化合物G;G常用作肥料,G彻底水解生成CO2和另一种气体H。试回答下列问题:
(1)试画出CaCN2中阴离子的共振结构式与共轭结构式:___ 、___ 。
(2)试写出字母A~H所代表物质的化学式:A___ 、B___ 、C___ 、D___ 、E___ 、F___ 、G___ 、H___ 。
(3)写出该问题中描述的下列有关反应的化学方程式:
CaCN2与H2O反应:___ ;
化合物A热分解:___ ;
化合物B与CO2、H2O反应___ ;
G彻底水解生成CO2和另一种气体H:___ 。
(4)画出G的Lewis结构式:___ 。
(5)F的结构式是___ ,画出其三种异构体的结构式(不考虑三元环)并命名:___ 。
第一步水解,CaCN2与H2O以1:1(物质的量比)反应,生成两种中间体A和B,它们都是含钙的离子化合物,这步反应可以描述为简单的酸碱反应。化合物A和B在热力学上不稳定,受热很容易分解。
化合物A热分解生成离子化合物C和共价化合物D,A与CO2反应,生成共价化合物D和新的离子化合物E。E热分解得到化合物C和CO2。化合物B与CO2、H2O反应生成E和新的共价化合物F,F简单水解(以1:1物质的量比),产生共价化合物G;G常用作肥料,G彻底水解生成CO2和另一种气体H。试回答下列问题:
(1)试画出CaCN2中阴离子的共振结构式与共轭结构式:
(2)试写出字母A~H所代表物质的化学式:A
(3)写出该问题中描述的下列有关反应的化学方程式:
CaCN2与H2O反应:
化合物A热分解:
化合物B与CO2、H2O反应
G彻底水解生成CO2和另一种气体H:
(4)画出G的Lewis结构式:
(5)F的结构式是
您最近半年使用:0次
2 . X、Y、Z为周期表前四周期中的常见元素。X的单质是人体呼吸及新陈代谢中必不少的气体。Y的单质也为气体,易溶于水,溶液呈浅黄绿色。Z的基态原子外围电子排布为3d64s2。
(1)将Z2X3与ZY3按等物质的量放在密闭管中加热使其恰好完全反应,只生成一种产物A,其物质的量是反应物的1.5倍。A为菱形片晶,具有金属光泽。此化学反应方程式为___ 。
(2)A不溶于冷水,但在沸水中缓慢水解,生成黄棕色沉淀B,溶液呈酸性,且无气泡产生。取水解后的上层清液,滴入硝酸银溶液,生成白色沉淀,说明Y在A中与___ 是直接相连的,所以水解时Y进入水中。B的化学式为___ 。
(3)将A溶于稀盐酸中,滴入硫氰化铵溶液,星红色,说明A中的Z的氧化数为___ ,A的命名应为___ 。
(1)将Z2X3与ZY3按等物质的量放在密闭管中加热使其恰好完全反应,只生成一种产物A,其物质的量是反应物的1.5倍。A为菱形片晶,具有金属光泽。此化学反应方程式为
(2)A不溶于冷水,但在沸水中缓慢水解,生成黄棕色沉淀B,溶液呈酸性,且无气泡产生。取水解后的上层清液,滴入硝酸银溶液,生成白色沉淀,说明Y在A中与
(3)将A溶于稀盐酸中,滴入硫氰化铵溶液,星红色,说明A中的Z的氧化数为
您最近半年使用:0次
3 . A、B、C、D、E是5种短周期元素,它们的原子序数依次增大。A与D、C与E分别为同一主族元素,B与C为同周期元素。甲是由A与B形成的在常温下为气态的共价化合物,乙是由A和C形成的在常温下为液态的共价化合物,丙是由C和D形成的固态离子化合物。甲、乙、丙的化学式中原子个数比都为1:1。丁由D和E形成的固态高子化合物,其中阳离子比阴离子少一个电子层。则各物质的化学式为甲_______ ;乙_______ 或_______ ;丙_______ 或_______ ;丁_______ 或_______ 。
您最近半年使用:0次
4 . (1)在1-18号元素中:原子半径最大的元素是___________ (填元素符号);金属性最强的元素是___________ (填元素符号);非金属性最强的元素是___________ (填元素符号);最高价氧化物对应的水化物酸性最强的物质是___________ (填化学式);最高价氧化物对应的水化物碱性最强的物质是___________ (填化学式);气态氢化物最稳定的是___________ (填化学式)。
(2)最高价氧化物对应水化物呈两性的物质与强酸反应的离子方程式为___________ ;与强碱反应的离子方程式为___________ 。
(2)最高价氧化物对应水化物呈两性的物质与强酸反应的离子方程式为
您最近半年使用:0次
解题方法
5 . X、Y、Z、W是原子序数依次增大的短周期主族元素,X、Z在周期表中的相对位置为:X,Y相邻在第二周期,Z、W相邻在第三周期,并且W原子半径最小(稀有气体半径不参与比较),X的单质在氧气中燃烧能生成两种无色气体,Y的最简单气态氢化物的水溶液显碱性。回答下列问题:
(1)元素X在周期表中位于________ 族;W和Z的气态氢化物稳定性比较,其较强的是_____ (填化学式)。
(2)W的单质与水反应生成的含氧酸的电子式为____
(3)在BaC12溶液中加入少量Y的最高价氧化物对应水化物溶液,再通入ZO2气体,能生成无色气体YO和白色沉淀___________ (填化学式);ZO2和YO还原性比较,其较强的是___________ (填化学式)。
(1)元素X在周期表中位于
(2)W的单质与水反应生成的含氧酸的电子式为
(3)在BaC12溶液中加入少量Y的最高价氧化物对应水化物溶液,再通入ZO2气体,能生成无色气体YO和白色沉淀
您最近半年使用:0次
名校
6 . 下表是元素周期表的一部分,回答有关问题。

(1)写出元素符号:①___ ,⑥___ 。
(2)在这些元素中,最活泼的金属元素的原子结构示意图为___ 。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最强的物质在水溶液中发生反应的离子方程式为___ 。
(4)在②、③、④、⑤这些元素形成的最简单离子中,离子半径由大到小的顺序为___ (填离子符号)。
(5)由元素②、③、⑧形成的一种常见的杀菌消毒剂中存在的化学键有___ 。
(6)由元素⑦和⑧形成的某种化合物可表示为X2Y2(其中各原子均满足8电子稳定结构),写出X2Y2的电子式:___ 。

(1)写出元素符号:①
(2)在这些元素中,最活泼的金属元素的原子结构示意图为
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最强的物质在水溶液中发生反应的离子方程式为
(4)在②、③、④、⑤这些元素形成的最简单离子中,离子半径由大到小的顺序为
(5)由元素②、③、⑧形成的一种常见的杀菌消毒剂中存在的化学键有
(6)由元素⑦和⑧形成的某种化合物可表示为X2Y2(其中各原子均满足8电子稳定结构),写出X2Y2的电子式:
您最近半年使用:0次
2020-07-12更新
|
255次组卷
|
5卷引用:安徽省桐城中学2021-2022学年高二上学期综合测试化学试题
名校
解题方法
7 . 现有 8 种元素的性质、数据如下表所列,它们属于第二或第三周期。
回答下列问题:
(1)④的元素名称是_____ ,⑧的元素符号是_____ 。②在元素周期表中的位置是(周期、族)_____ 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_____ ;名称是________ ; 碱性最强的化合物的电子式是:_________ ; 属_____ 化合物(填“离子”或“共价”)。
(3)①的最简单氢化物的电子式为_____ , ⑦的最简单氢化物的电子式为_____ ,结构式为_____ 。
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:_________________ 。
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:____________ 。
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
回答下列问题:
(1)④的元素名称是
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是
(3)①的最简单氢化物的电子式为
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:
您最近半年使用:0次
2020-04-17更新
|
122次组卷
|
2卷引用:安徽省阜阳市临泉县第一中学2019-2020学年高一下学期第一次月考化学试题
8 . 已知A、B、C、D、E是原子序数依次增大的五种短周期元素,A、C同主族,A与B、A与E形成共价化合物,A与B形成化合物的水溶液呈碱性,E元素的最高正化合价与最低负化合价的代数和为6,D是同周期中离子半径最小的元素。
(1)写出C元素的原子结构示意图____________________ ,用电子式写出C和E形成化合物的过程___________________ ,用电子式写出A和B形成化合物的过程_________________ 。
(2)B元素的气态氢化物与其最高价氧化物对应的水化物反应生成的化合物中存在化学键的类型为______________
(3)C元素的最高价氧化物对应的水化物与D元素的最高价氧化物反应的离子方程式为________ 。
(4)已知X、Y、Z三种物质中均含有上述元素中的某一种元素,它们之间存在如图所示转化关系。

①X、Y、Z均含有上述元素中的同一种金属元素,若W固体俗称干冰,则反应Y→Z的离子方程为____________________________ ;
②X、Y、Z均含有上述元素中的同一种金属元素,若W是强碱,且Y为白色难溶固体,则反应Z→Y的离子方程式为________________________ 。
③X、Y、Z是均含有上述元素中的同一种非金属元素的化合物,W是一种常见金属单质,且上述转化均在常温条件下完成,则反应Z→Y的离子方程式__________________________ 。
(1)写出C元素的原子结构示意图
(2)B元素的气态氢化物与其最高价氧化物对应的水化物反应生成的化合物中存在化学键的类型为
(3)C元素的最高价氧化物对应的水化物与D元素的最高价氧化物反应的离子方程式为
(4)已知X、Y、Z三种物质中均含有上述元素中的某一种元素,它们之间存在如图所示转化关系。

①X、Y、Z均含有上述元素中的同一种金属元素,若W固体俗称干冰,则反应Y→Z的离子方程为
②X、Y、Z均含有上述元素中的同一种金属元素,若W是强碱,且Y为白色难溶固体,则反应Z→Y的离子方程式为
③X、Y、Z是均含有上述元素中的同一种非金属元素的化合物,W是一种常见金属单质,且上述转化均在常温条件下完成,则反应Z→Y的离子方程式
您最近半年使用:0次
名校
9 . 随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
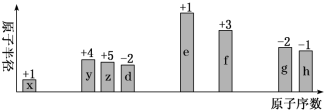
根据判断出的元素回答问题:
上述元素可组成盐R:zx4f(gd4)2。向盛有10mL 1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下:
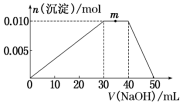
(1)R溶液中,离子浓度由大到小的顺序是___________________________________
(2)写出m点反应的离子方程式:__________________________________________ 。
(3)若在R溶液中改加20mL 1.2mol·L-1 Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为________ mol。

根据判断出的元素回答问题:
上述元素可组成盐R:zx4f(gd4)2。向盛有10mL 1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下:

(1)R溶液中,离子浓度由大到小的顺序是
(2)写出m点反应的离子方程式:
(3)若在R溶液中改加20mL 1.2mol·L-1 Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为
您最近半年使用:0次
2018-09-24更新
|
250次组卷
|
4卷引用:安徽省阜阳市临泉县第一中学2019届高三上学期第三次模拟(12月)化学试题
10 . 已知A、B、C、D、E为原子序数依次增大的五种短周期元素,A与B形成的共价化合物M的水溶液呈碱性,C原子的最内电子数是最外层电子数的2倍,D是同周期中单核离子半径最小的元素,E元素的最高正价与最低负价的代数和为6。请回答下列问题:
(1)化合物M的电子式为_________
(2)B、C所形成的简单离子中,半径较大的是________ 用离子符号表示)。
(3)E的单质与A的简单氧化物反应的离子方程式为________
(4)A、D形成的化合物DA3与水反应生成无色气体,则该反应的化学方程式为________ ,每生成1mol气体转移的电子数为_________ 。
(5)工业上,将CEO3与Na2SO3溶液混合,再加入转H2SO4制备净水剂EO2,则该反应的离子方程式为__________
(6)COA的水溶液和AE溶液反应,生成0.5mol水时放出的热量为28.65kJ,则该反应的热化学方程式为_________
(1)化合物M的电子式为
(2)B、C所形成的简单离子中,半径较大的是
(3)E的单质与A的简单氧化物反应的离子方程式为
(4)A、D形成的化合物DA3与水反应生成无色气体,则该反应的化学方程式为
(5)工业上,将CEO3与Na2SO3溶液混合,再加入转H2SO4制备净水剂EO2,则该反应的离子方程式为
(6)COA的水溶液和AE溶液反应,生成0.5mol水时放出的热量为28.65kJ,则该反应的热化学方程式为
您最近半年使用:0次



