名校
1 . A、B、C、D、E为常见的主族元素,根据下表信息回答问题。
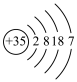
(1)写出元素A的原子结构示意图___________ 。
(2)A、B最高价氧化物对应水化物的碱性强弱:___________ >___________ (填化学式),从原子结构角度解释原因___________ 。
(3)写出A、B最高价氧化物对应水化物二者反应的离子方程式________________ 。
(4)用电子式表示C和D形成化合物的过程:_______________ 。
(5)元素E在周期表中的位置___________ ,关于元素E及其化合物的推断中,正确的是___________ 。
a.E与D的最低负化合价相同 b.E的单质可与A和D形成的化合物的水溶液发生置换反应
c.最高价氧化物对应水化物的酸性:E>D d.氢化物稳定性:E<D
(6)D和E形成的化合物①具有氧化性,其中体现氧化性的元素是(写元素符号)___________ ,原因是________________ 。
(7)元素M与A同主族,比A多2个电子层,M与氧以2:1比例形成的化合物②的物质类别为___________ ,任意写出一个能体现②的类别通性的反应方程式_____________ 。
(8)第四周期ⅥA族的元素硒 是一种人体必需的元素,关于硒元素及其化合物的有关说法正确的是(选填序号)
是一种人体必需的元素,关于硒元素及其化合物的有关说法正确的是(选填序号)___________ 。
a.硒原子的半径比硫原子的大 b. 的稳定性比HCl的强
的稳定性比HCl的强
c. 能与NaOH溶液反应 d.
能与NaOH溶液反应 d. 可以使酸性高锰酸钾溶液褪色
可以使酸性高锰酸钾溶液褪色
| 元素 | 元素性质/原子结构信息 |
| A | 短周期元素原子半径最大(稀有气体不参与比较) |
| B | +3价阳离子的核外电子排布与氖原子相同 |
| C | 原子核外M电子层与K电子层的电子数相等 |
| D | 与A同周期,化合价有-1、+7等 |
| E | 原子结构示意图: |
(1)写出元素A的原子结构示意图
(2)A、B最高价氧化物对应水化物的碱性强弱:
(3)写出A、B最高价氧化物对应水化物二者反应的离子方程式
(4)用电子式表示C和D形成化合物的过程:
(5)元素E在周期表中的位置
a.E与D的最低负化合价相同 b.E的单质可与A和D形成的化合物的水溶液发生置换反应
c.最高价氧化物对应水化物的酸性:E>D d.氢化物稳定性:E<D
(6)D和E形成的化合物①具有氧化性,其中体现氧化性的元素是(写元素符号)
(7)元素M与A同主族,比A多2个电子层,M与氧以2:1比例形成的化合物②的物质类别为
(8)第四周期ⅥA族的元素硒
 是一种人体必需的元素,关于硒元素及其化合物的有关说法正确的是(选填序号)
是一种人体必需的元素,关于硒元素及其化合物的有关说法正确的是(选填序号)a.硒原子的半径比硫原子的大 b.
 的稳定性比HCl的强
的稳定性比HCl的强c.
 能与NaOH溶液反应 d.
能与NaOH溶液反应 d. 可以使酸性高锰酸钾溶液褪色
可以使酸性高锰酸钾溶液褪色
您最近一年使用:0次
名校
2 . 元素周期表与元素周期律在学习、研究中有很重要的作用。
Ⅰ.我国科研团队成功研发“硅一石墨烯—锗晶体管”,代表着我国在这一尖端科技领域走在了世界的前列。
(1)碳元素在元素周期表中的位置是第______ 周期、第IVA族。
(2)硅元素最高价氧化物的化学式为______ 。
(3)锗(Ge)位于第4周期,与Si同主族。下列关于锗(Ge)的推断中,正确的是______ (填字母)。
a.原子的最外层电子数为4
b.原子半径:
c.最高价氧化物对应的水化物酸性强于
Ⅱ.下表是元素周期表中7种元素的相关信息,其中A、Q、W、X位于同一周期。
回答下列问题:
(4)用电子式表示化合物XW的形成过程:______ 。
(5) 中含有
中含有______ 键和______ 键。
(6)下列说法正确的是______ (填字母序号)。
a.Q的单质是良好的半导体材料
b.形状和大小相同的A、X的单质与同浓度盐酸反应,A的单质更剧烈
c.R最高价氧化物对应的水化物与R的气态氢化物反应的产物是离子化合物
d.Z的单质可与X和W形成的化合物的水溶液发生置换反应
(7)实验室制取R的氢化物的化学方程式:______ 。
(8)依据元素周期律预测硼酸( )的性质。下列关于硼酸的说法正确的是
)的性质。下列关于硼酸的说法正确的是______ (填序号)
a.硼酸是弱酸
b.向 固体中滴加饱和硼酸溶液,有气泡产生
固体中滴加饱和硼酸溶液,有气泡产生
c.比较酸性:
Ⅰ.我国科研团队成功研发“硅一石墨烯—锗晶体管”,代表着我国在这一尖端科技领域走在了世界的前列。
(1)碳元素在元素周期表中的位置是第
(2)硅元素最高价氧化物的化学式为
(3)锗(Ge)位于第4周期,与Si同主族。下列关于锗(Ge)的推断中,正确的是
a.原子的最外层电子数为4
b.原子半径:

c.最高价氧化物对应的水化物酸性强于

Ⅱ.下表是元素周期表中7种元素的相关信息,其中A、Q、W、X位于同一周期。
| 元素 | 信息 |
| A | 最高价氧化物对应的水化物是两性氢氧化物 |
| W | 最高正化合价为+7价 |
| X | 最高价氧化物对应的水化物在本周期中碱性最强 |
| Y | 和X能形成 和 和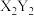 两种离子化合物 两种离子化合物 |
| Q | 位于第3周期、第IVA族 |
| R | 位于短周期,最高价氧化物对应的水化物的化学式为 |
| Z | 原子结构示意图为 |
(4)用电子式表示化合物XW的形成过程:
(5)
 中含有
中含有(6)下列说法正确的是
a.Q的单质是良好的半导体材料
b.形状和大小相同的A、X的单质与同浓度盐酸反应,A的单质更剧烈
c.R最高价氧化物对应的水化物与R的气态氢化物反应的产物是离子化合物
d.Z的单质可与X和W形成的化合物的水溶液发生置换反应
(7)实验室制取R的氢化物的化学方程式:
(8)依据元素周期律预测硼酸(
 )的性质。下列关于硼酸的说法正确的是
)的性质。下列关于硼酸的说法正确的是a.硼酸是弱酸
b.向
 固体中滴加饱和硼酸溶液,有气泡产生
固体中滴加饱和硼酸溶液,有气泡产生c.比较酸性:

您最近一年使用:0次
3 . 现有A、B、X、Y、Z五种短周期主族元素,原子序数逐渐增大。它们的性质或原子结构如下表:
请回答:
(1)写出X在元素周期表中的位置_______ 。
(2)比较X、Y的离子半径:X的离子半径_______ Y的离子半径(填“>”“<”“=”)。
(3)检验BA3的方法和现象_______ 。
(4)用电子式表示化合物YZ的形成过程_______ 。
(5)W元素的核电荷数是B、X的核电荷数的和,则W与B的气态氢化物稳定性为_______ (填化学式)。
| 元素 | 性质或原子结构 |
| A | 原子核内只有一个质子 |
| B | 单质是空气中含量最多的气体 |
| X | 原子的最外层电子数是次外层电子数的3倍 |
| Y | 短周期元素中原子半径最大的元素 |
| Z | 最高正化合价与最低负化合价的代数和为6 |
(1)写出X在元素周期表中的位置
(2)比较X、Y的离子半径:X的离子半径
(3)检验BA3的方法和现象
(4)用电子式表示化合物YZ的形成过程
(5)W元素的核电荷数是B、X的核电荷数的和,则W与B的气态氢化物稳定性为
您最近一年使用:0次
名校
解题方法
4 . 黑火药爆炸时发生的反应: 。
。
(1)上述反应涉及的元素中,非金属性最强的是________ (填元素符号,下同),原子半径最大的是________ ,属于第二周期的元素是________ ;
(2)某元素的气态氢化物的水溶液呈碱性,则它在元素周期表中的位置是________________ ,与它同主族的短周期元素的原子结构示意图是________________ ;
(3)上述反应的生成物中属于共价化合物,请写出其结构式________________ ,写出一种由氢、氮、氧三种元素组成的离子化合物的化学式________________ ;
(4)写出K、N最高价氧化物对应水化物之间发生反应的化学方程式:________________ .
(5)氧、硫的非金属性强弱可通过比较这两种元素_________ (选填编号)
a.原子的得电子的能力 b.含氧酸的酸性
c.气态氢化物的稳定性 d.单质的熔沸点
(6)Na与K同主族,金属性强的是_________ (填元素符号),请写出一个实验事实说明:__________ 。
 。
。(1)上述反应涉及的元素中,非金属性最强的是
(2)某元素的气态氢化物的水溶液呈碱性,则它在元素周期表中的位置是
(3)上述反应的生成物中属于共价化合物,请写出其结构式
(4)写出K、N最高价氧化物对应水化物之间发生反应的化学方程式:
(5)氧、硫的非金属性强弱可通过比较这两种元素
a.原子的得电子的能力 b.含氧酸的酸性
c.气态氢化物的稳定性 d.单质的熔沸点
(6)Na与K同主族,金属性强的是
您最近一年使用:0次
名校
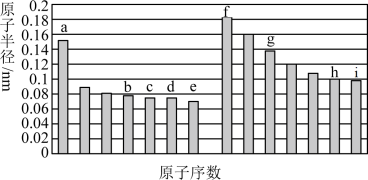
5 . 部分短周期主族元素原子半径与原子序数的关系如图,根据所学知识回答下列问题。 、
、 、
、 、
、 四种元素的最简单氢化物中,最稳定的是
四种元素的最简单氢化物中,最稳定的是________ (填化学式)。
(2) 与
与 能形成一种淡黄色的物质,其电子式为
能形成一种淡黄色的物质,其电子式为________ 。
(3) 的最高价氧化物对应的水化物与
的最高价氧化物对应的水化物与 的最高价氧化物对应的水化物反应的离子方程式为
的最高价氧化物对应的水化物反应的离子方程式为________ 。
(4)由 的单质制成的电池需要注意防水,其原因为
的单质制成的电池需要注意防水,其原因为________ (用化学方程式表示)。
(5)门捷列卡在研究元素周期表时,科学地预言了11种当时尚未发现的元素,他认为 的下一周期存在一种“类
的下一周期存在一种“类 ”元素,该元素多年后被法国化学家发现,命名为镓(Ga),镓在元素周期表中的位置为
”元素,该元素多年后被法国化学家发现,命名为镓(Ga),镓在元素周期表中的位置为________ 。预测 与
与 的最高价氧化物对应水化物的碱性较强的是
的最高价氧化物对应水化物的碱性较强的是________ (填最高价氧化物对应水化物的化学式)。
(6)使用下列装置再添加合适的药品,可以证明 和
和 两种元素的非金属性强弱顺序,可供选择的药品为:①浓硫酸②稀硫酸③盐酸④
两种元素的非金属性强弱顺序,可供选择的药品为:①浓硫酸②稀硫酸③盐酸④ 固体⑤
固体⑤ ⑥澄清石灰水⑦NaOH溶液
⑥澄清石灰水⑦NaOH溶液________ 、丁________ 。
 、
、 、
、 、
、 四种元素的最简单氢化物中,最稳定的是
四种元素的最简单氢化物中,最稳定的是(2)
 与
与 能形成一种淡黄色的物质,其电子式为
能形成一种淡黄色的物质,其电子式为(3)
 的最高价氧化物对应的水化物与
的最高价氧化物对应的水化物与 的最高价氧化物对应的水化物反应的离子方程式为
的最高价氧化物对应的水化物反应的离子方程式为(4)由
 的单质制成的电池需要注意防水,其原因为
的单质制成的电池需要注意防水,其原因为(5)门捷列卡在研究元素周期表时,科学地预言了11种当时尚未发现的元素,他认为
 的下一周期存在一种“类
的下一周期存在一种“类 ”元素,该元素多年后被法国化学家发现,命名为镓(Ga),镓在元素周期表中的位置为
”元素,该元素多年后被法国化学家发现,命名为镓(Ga),镓在元素周期表中的位置为 与
与 的最高价氧化物对应水化物的碱性较强的是
的最高价氧化物对应水化物的碱性较强的是(6)使用下列装置再添加合适的药品,可以证明
 和
和 两种元素的非金属性强弱顺序,可供选择的药品为:①浓硫酸②稀硫酸③盐酸④
两种元素的非金属性强弱顺序,可供选择的药品为:①浓硫酸②稀硫酸③盐酸④ 固体⑤
固体⑤ ⑥澄清石灰水⑦NaOH溶液
⑥澄清石灰水⑦NaOH溶液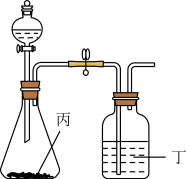
您最近一年使用:0次
名校
6 . 日常生活中常用A的单质通入自来水中杀菌消毒,B的单质或合金做电线的导体部分。A的负一价离子的最外层电子数和次外层电子数相同。B为第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。
(1)B元素在周期表中的位置是___________ 。
(2)A与B形成的一种化合物的立方晶胞如图所示:___________ 。
②该晶胞棱长为0.542nm,则晶体的密度为___________ g/cm3(写出计算式即可,不计算结果)。
(3)如图A、B形成离子晶体的晶格能为___________ kJ/mol。 ,
, ,
, )。则D原子的坐标参数为
)。则D原子的坐标参数为___________ ,它代表___________ 原子。
①黄砷结构与白磷相似,黄砷的空间构型为___________ 。
②近年来,黑砷在催化电解水方面的研究受到关注,其晶体结构与石墨类似。根据图中信息,下列说法正确的有___________ (填标号)。
b.黑砷与C60都属于混合型晶体
c.黑砷单层中As原子与As-As键的个数比为2:3
d.黑砷层与层之间的作用力为范德华力
(1)B元素在周期表中的位置是
(2)A与B形成的一种化合物的立方晶胞如图所示:

②该晶胞棱长为0.542nm,则晶体的密度为
(3)如图A、B形成离子晶体的晶格能为

 ,
, ,
, )。则D原子的坐标参数为
)。则D原子的坐标参数为
①黄砷结构与白磷相似,黄砷的空间构型为
②近年来,黑砷在催化电解水方面的研究受到关注,其晶体结构与石墨类似。根据图中信息,下列说法正确的有

b.黑砷与C60都属于混合型晶体
c.黑砷单层中As原子与As-As键的个数比为2:3
d.黑砷层与层之间的作用力为范德华力
您最近一年使用:0次
名校
解题方法
7 . X、Y、Z、M、N是五种短周期元素,原子序数依次增大。X原子中没有中子,Y元素最高正价与最低负价之和为0;M与X同主族;Z、N分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)Z、M、N三种元素对应离子半径由大到小的顺序是________ (离子符号表示)。
(2)X与Y组成的最简单化合物的电子式为__________ 。
(3)M的金属性比N强,出能证明该结论的一个事实________ 。
(1)Z、M、N三种元素对应离子半径由大到小的顺序是
(2)X与Y组成的最简单化合物的电子式为
(3)M的金属性比N强,出能证明该结论的一个事实
您最近一年使用:0次
8 . 已知a、b、d、e、 f、g、 h为原子序数依次增大的六种短周期主族元素, 非金属元素a最外层电子数与其周期数相同,b原子的最外层电子数是其所在周期数的2倍。d的一种单质可杀菌消毒,g的最高正价与最低负价代数和为4, f的最高价氧化物可分别与e和h的最高价氧化物的水化物反应,a单质在h单质中燃烧,产物溶于水得到一种强酸甲。请用化学用语回答下列问题:
(1)f在元素周期表中的位置___________ 画出与h同族的第四周期元素的原子结构示意图___________ 。
(2)d、e、f、h的简单离子的半径由大到小的顺序___________ 。
(3)下列说法正确的是___________。
(4)设计一个简单的实验证明d和g的非金属性强弱:___________ (用化学方程式表示)。
(5)为降低水源中NO 对人体的危害,可在强碱性条件下用f的单质将溶液中的NO
对人体的危害,可在强碱性条件下用f的单质将溶液中的NO 还原为N2,该反应的离子方程式为
还原为N2,该反应的离子方程式为___________ 。
(6)将e和f单质各1mol投入足量水中,充分反应后,所得溶液体积为500mL,则该过程可得标况下气体体积___________ L。
(1)f在元素周期表中的位置
(2)d、e、f、h的简单离子的半径由大到小的顺序
(3)下列说法正确的是___________。
| A.氢化物的稳定性d>b |
| B.含氧酸的酸性h>g>b>f |
| C.bg2中b为+4价;g为−2价可说明g的非金属性强于b |
| D.g阴离子能与Fe3+反应而h的阴离子不能,可说明g的非金属性弱于h |
(5)为降低水源中NO
 对人体的危害,可在强碱性条件下用f的单质将溶液中的NO
对人体的危害,可在强碱性条件下用f的单质将溶液中的NO 还原为N2,该反应的离子方程式为
还原为N2,该反应的离子方程式为(6)将e和f单质各1mol投入足量水中,充分反应后,所得溶液体积为500mL,则该过程可得标况下气体体积
您最近一年使用:0次
9 . 现有部分短周期主族元素的性质或原子结构如下表:
(1)元素X的一种同位素可测定文物年代,这种同位素的化学符号是___________ 。
(2)元素Y与氢元素形成一种阳离子,该阳离子为___________ 。
(3)元素Z与元素T相比,非金属性较强的是___________ (用元素符号表示),下列表述中能证明这一事实的是___________ 。
a.常温下Z的单质和T的单质状态不同
b.Z的简单氢化物比T的简单氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)T的一种氧化物能使Z单质的水溶液褪色,该反应的离子方程式___________ 。
(5)T在周期表中的位置是第___________ 周期___________ 族。
| 元素编号 | 元素性质或原子结构 |
| T | M层上电子数是K层上电子数的3倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高化合价是+7价 |
(2)元素Y与氢元素形成一种阳离子,该阳离子为
(3)元素Z与元素T相比,非金属性较强的是
a.常温下Z的单质和T的单质状态不同
b.Z的简单氢化物比T的简单氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)T的一种氧化物能使Z单质的水溶液褪色,该反应的离子方程式
(5)T在周期表中的位置是第
您最近一年使用:0次
名校
10 . 有A、B、D、E、X、Y、Z七种短周期元素。X与Y处于同一周期,Y的最高价氧化物对应的水化物与强酸、强碱均能反应。Z的单质常温下为气态,其相对分子质量是氢气的35.5倍。其余元素的信息如图所示:
(1)E在周期表中的位置是___________ 。
(2)A、B、D三种元素所形成的化合物ABD的电子式为___________ 。
(3)A、D、Z三种元素所形成的化合物DA4Z中的化学键类型是___________ 。
(4)X的最高价氧化物对应水化物与Y的最高价氧化物对应水化物反应的离子方程式为___________ 。
(5)下列可以判断X和Y元素原子失电子能力强弱的是___________ (填字母序号)。
a.单质的熔点X比Y低 b.单质与水反应X比Y剧烈
c.单质与酸反应时,失电子数X比Y少 d.最高价氧化物的水化物的碱性X比Y强
(6)E和Z的最高价氧化物对应水化物的酸性:___________ >___________ (填化学式)。

(1)E在周期表中的位置是
(2)A、B、D三种元素所形成的化合物ABD的电子式为
(3)A、D、Z三种元素所形成的化合物DA4Z中的化学键类型是
(4)X的最高价氧化物对应水化物与Y的最高价氧化物对应水化物反应的离子方程式为
(5)下列可以判断X和Y元素原子失电子能力强弱的是
a.单质的熔点X比Y低 b.单质与水反应X比Y剧烈
c.单质与酸反应时,失电子数X比Y少 d.最高价氧化物的水化物的碱性X比Y强
(6)E和Z的最高价氧化物对应水化物的酸性:
您最近一年使用:0次