名校
解题方法
1 .  模型中的小黑点表示电子在原子核外出现的概率密度的形象描述
模型中的小黑点表示电子在原子核外出现的概率密度的形象描述______ 。
 模型中的小黑点表示电子在原子核外出现的概率密度的形象描述
模型中的小黑点表示电子在原子核外出现的概率密度的形象描述
您最近半年使用:0次
2 . 图1和图2分别表示1s电子的概率分布和原子轨道,下列说法正确的是


| A.图1中的每个小黑点表示1个电子 |
| B.图2表示1s电子只能在球体内出现 |
| C.图2表明1s轨道呈球形,有无数对称轴 |
| D.图1中的小黑点表示某一时刻,电子在核外所处的具体位置 |
您最近半年使用:0次
2022-06-17更新
|
139次组卷
|
8卷引用:【全国百强校】吉林省延边第二中学2018-2019学年高二下学期第一次月考化学试题
【全国百强校】吉林省延边第二中学2018-2019学年高二下学期第一次月考化学试题福建省罗源市第一中学2018-2019学年高二下学期3月月考化学试题课时2 原子轨道的图形描述与电子云——A学习区 夯实基础(鲁科版选修3)广西田东县田东中学2020-2021学年高二上学期12月月考化学试题吉林省通化市2021-2022学年高二下学期期中联考化学试题(人教版2019)选择性必修2第一章 原子结构与性质 第一节 原子结构 第3课时 电子云与原子轨道鲁科版2019选择性必修2第1章 原子结构与元素性质 第1节 原子结构模型 第2课时 量子力学对原子核外电子运动状态的描述安徽省滁州市定远县民族中学2021-2022学年高二下学期第一次教学检测化学试题
3 . 描述硅原子核外电子运动说法错误的是
| A.有4种不同的伸展方向 |
| B.有14种不同运动状态的电子 |
| C.有5种不同能量的电子 |
| D.有5种不同的空间运动状态 |
您最近半年使用:0次
2021-10-30更新
|
652次组卷
|
8卷引用:2015届上海市十三校高三第二次联考化学试卷
2015届上海市十三校高三第二次联考化学试卷河北省邢台市第二中学2018-2019学年高二下学期第四次月考化学试题2017-2018学年上海复旦附中高三化学第一次月考测试题河北省石家庄市第一中学2019-2020学年高二下学期第一次月考化学试题吉林省长春市十一高中2021-2022学年高二下学期第二学程考试化学试题(已下线)1.1.3 电子云与原子轨道 泡利原理与洪特规则 能量最低原理(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)1.1.2 构造原理与电子排布式-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)新疆乌鲁木齐市第101中学2021-2022学年高二下学期期末考试化学试题
名校
解题方法
4 . 下列关于原子结构、原子轨道的说法正确的是
| A.N能层中有4s、4p、4d、4f四个能级,共16个轨道,可容纳32种运动状态的电子 |
| B.在K能层中,有自旋相反的两条轨道 |
| C.s电子绕核运动,其轨道为球面,而p电子在纺锤形曲面上运动 |
| D.电子云通常是用小黑点来表示电子的多少 |
您最近半年使用:0次
2020-10-29更新
|
906次组卷
|
8卷引用:四川省内江市第六中学2020-2021学年高二上学期第一次月考化学试题
四川省内江市第六中学2020-2021学年高二上学期第一次月考化学试题(已下线)第16单元 物质的结构与性质(选考)(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷(已下线)练习11 原子结构-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)吉林省通化市梅河口市第五中学2023-2024学年高二上学期第三次月考化学试题(已下线)第1章 原子结构与元素性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)河北省邯郸市大名县第一中学2021-2022学年高二上学期第二次月考化学试题(已下线)第1讲 原子结构 核外电子排布四川省泸州市叙永第一中学校2023-2024学年高二上学期1月期末化学试题
5 . 中科院宁波研究所的“固态锂电池”即将量产,其技术世界领先。请完成下列问题:
(1)基态锂原子的电子排布式:______ ;基态锂原子中有_____ 种运动状态不同的电子。
(2)LiAlH4是重要的还原剂与储氢材料。其合成方法如下:① Na+Al+2H2 NaAlH4,②NaAlH4+LiCl
NaAlH4,②NaAlH4+LiCl LiAlH4+NaCl。
LiAlH4+NaCl。
①上述反应中涉及的元素的原子半径最大的是______ (填元素名称)。
②LiAlH4与水剧烈反应产生一种盐与 H2,写出反应的化学方程式:_______ 。
③LiAlH4中 H元素表现为-1价,Li元素为+1价,解释H表现出负价的理由:_______ 。
(3)Mg与 Al的电离能如下(kJ·mol-1):
第一电离能 Mg大于 Al,但第二电离能 Mg小于 Al,解释原因:_________ 。
(4)上述物质的元素中电负性最大的元素与电负性最小的元素形成的化合物的电子式为__________ 。
(1)基态锂原子的电子排布式:
(2)LiAlH4是重要的还原剂与储氢材料。其合成方法如下:① Na+Al+2H2
 NaAlH4,②NaAlH4+LiCl
NaAlH4,②NaAlH4+LiCl LiAlH4+NaCl。
LiAlH4+NaCl。①上述反应中涉及的元素的原子半径最大的是
②LiAlH4与水剧烈反应产生一种盐与 H2,写出反应的化学方程式:
③LiAlH4中 H元素表现为-1价,Li元素为+1价,解释H表现出负价的理由:
(3)Mg与 Al的电离能如下(kJ·mol-1):
| Mg | 737.7 | 1450.7 | … |
| Al | 577.5 | 1816.7 | … |
(4)上述物质的元素中电负性最大的元素与电负性最小的元素形成的化合物的电子式为
您最近半年使用:0次
2020-08-21更新
|
164次组卷
|
3卷引用:吉林省松原市扶余市第一中学2019-2020学年高二下学期期中考试化学试题
吉林省松原市扶余市第一中学2019-2020学年高二下学期期中考试化学试题山西省运城市2019-2020学年高二下学期期末测试化学试题(已下线)第01章 原子结构与元素性质(A卷基础强化篇)-2020-2021学年高二化学选择性必修2同步单元AB卷(新教材鲁科版)
6 . 下面表示锂原子结构的化学用语中,对核外电子运动状态描述最详尽的是
| A.Li | B. | C.1s22s1 | D.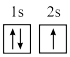 |
您最近半年使用:0次
2020-07-26更新
|
96次组卷
|
5卷引用:河南省信阳市2019-2020学年高二下学期期末教学质量检测化学试题
名校
解题方法
7 . 下列叙述错误的是( )
①热稳定性:H2O>HF>H2S ②熔点:Al>Na>K ③ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布 ④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素⑤多电子原子中,在离核较近的区域内运动的电子能量较高 ⑥盐酸可与碳酸钠溶液反应生成CO2气体,说明盐酸比碳酸强,则Cl 比S的非金属性强 ⑦SiCl4、PCl3分子中各原子最外层均达到8电子稳定结构。
①热稳定性:H2O>HF>H2S ②熔点:Al>Na>K ③ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布 ④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素⑤多电子原子中,在离核较近的区域内运动的电子能量较高 ⑥盐酸可与碳酸钠溶液反应生成CO2气体,说明盐酸比碳酸强,则Cl 比S的非金属性强 ⑦SiCl4、PCl3分子中各原子最外层均达到8电子稳定结构。
| A.①③⑤⑥ | B.②④⑥ | C.②③④⑦ | D.①⑤⑥ |
您最近半年使用:0次
2020-06-04更新
|
156次组卷
|
4卷引用:四川省遂宁市船山区第二中学校2019-2020学年高一下学期期中考试化学试题
四川省遂宁市船山区第二中学校2019-2020学年高一下学期期中考试化学试题甘肃省静宁县第一中学2019-2020学年高二下学期期中考试(第二次月考)化学试题(实验班)(已下线)第02练 元素周期律-2020年【衔接教材·暑假作业】新高二化学(人教版)吉林省白城市第一中学2020-2021学年高二下学期月考化学试题
名校
解题方法
8 . 下列有关多电子原子的叙述中正确的是( )
| A.在一个多电子原子中,不可能有两个运动状态完全相同的电子 |
| B.在一个多电子原子中,不可能有两个能量相同的电子 |
| C.在一个多电子原子中,N层上的电子能量肯定比M层上的电子能量高 |
| D.某个多电子原子的3p轨道上仅有两个电子,它们的自旋状态必须相反 |
您最近半年使用:0次
2020-04-03更新
|
370次组卷
|
7卷引用:2014-2015福建省四地六校高二下学期第一次联考化学试卷
名校
9 . 下列各项叙述中正确的是 ( )
| A.电子层序数越大,s原子轨道的形状相同,半径越大 |
| B.在同一电子层上运动的电子,其自旋方向肯定不同 |
| C.镁原子由1s22s22p63s2→1s22s22p63p2时,释放能量,由基态转化成激发态 |
| D.杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对 |
您最近半年使用:0次
2019-06-14更新
|
1012次组卷
|
16卷引用:2016-2017学年河南省商丘市第一高级中学高二上学期期末考试化学试卷
2016-2017学年河南省商丘市第一高级中学高二上学期期末考试化学试卷河南省兰考县第二高级中学2017-2018学年高二下学期期中考试化学试题鲁科版高中化学选修3模块综合测评卷安徽省安庆市太湖县2019-2020学年高二下学期期中质量调研考试化学试题安徽省蚌埠第三中学2019-2020学年高二下学期期末考试化学试题吉林省延边朝鲜族自治州延边二中北校区2020-2021学年高二下学期第一次月考化学试题(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记宁夏吴忠市吴忠中学2020-2021学年高二3月月考化学试题新疆昌吉教育共同体2020-2021学年高二下学期期中考试化学试题(已下线)专题14 物质结构与性质-备战2022年高考化学学霸纠错(全国通用)四川省西昌市2020-2021学年高二下学期期中检测化学试题湖南省衡阳市田家炳实验中学2021-2022学年高二下学期3月质量检测化学试题山东省德州市2021-2022学年高二下学期物质结构与性质模块综合测评化学试题新疆乌鲁木齐高级中学2021-2022学年高二上学期期末考试化学试题山东省乳山市银滩高级中学2022-2023学年高一下学期3月月考化学试题黑龙江省牡丹江市第二高级中学2022-2023学年高二下学期7月期末化学试题
10 . 下列有关说法正确的是
| A.每个能层s能级的原子轨道的形状相同,能层序数越大,轨道半径越大,电子能量越高 |
| B.原子核外电子云是核外电子运动后留下的痕迹 |
| C.教材中说“核外电子的概率密度分布看起来像一片云雾,因为被形象地称作电子云”,这说明原子核外电子云是实际存在的 |
| D.每个能层都有P能级,P能级都有3个原子轨道 |
您最近半年使用:0次
2019-04-26更新
|
234次组卷
|
3卷引用:【校级联考】四川省蓉城名校联盟2018-2019学年高二下学期期中考试化学试题



