名校
1 . 硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]是分析化学中的重要试剂,是一种复盐,一般亚铁盐在空气中易被氧化,形成复盐后就比较稳定。与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,利用这一性质可以用等物质的量的(NH4)2SO4和FeSO4混合制备。请回答以下问题:
I.硫酸亚铁铵晶体的制备
步骤一:称取3.0 g铁屑,加入15 mL 10% Na2CO3溶液,小火加热30分钟,过滤洗涤、干燥、称量得固体m1 g。
步骤二:将步骤一中的m1 g固体转移至锥形瓶,加入15 mL 3 mol·L-1 H2SO4,加热至不再有气体生成,趁热过滤,洗涤固体,将滤液和洗涤液合并后转移至蒸发皿中备用,准确称量剩余固体质量得m2 g。
步骤三:计算所得FeSO4的物质的量,计算等物质的量的(NH4)2SO4固体的质量,准确称取(NH4)2SO4。
步骤四:将(NH4)2SO4固体加入蒸发皿中,缓慢加热浓缩至表面出现结晶薄膜为止,放置冷却。
步骤五:经过一系列操作,最终得到较纯净的(NH4)2FeSO4·6H2O。
(1)N、O、H三种元素的第一电离能由大到小的顺序为___________ (用元素符号表示)
(2)步骤一中加入10% Na2CO3溶液,小火加热30分钟的目的是___________
(3)关于步骤五中的一系列操作的相关表述,错误的是___________(填字母)。
II.硫酸亚铁铵的分解
已知硫酸亚铁铵在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500 ℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。
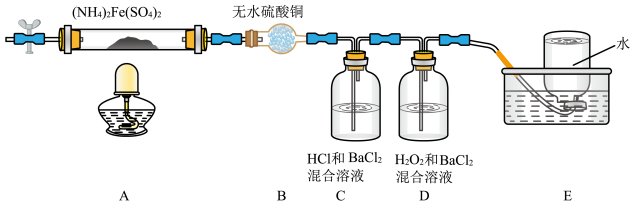
(4)B装置的作用是___________
(5)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定分解产物中的某种气体,写出D中发生反应的离子方程式___________ ;若去掉C,是否能得出同样结论,并解释其原因___________ 。
(6)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3而不含FeO。其预期实验现象为:___________ 。
I.硫酸亚铁铵晶体的制备
步骤一:称取3.0 g铁屑,加入15 mL 10% Na2CO3溶液,小火加热30分钟,过滤洗涤、干燥、称量得固体m1 g。
步骤二:将步骤一中的m1 g固体转移至锥形瓶,加入15 mL 3 mol·L-1 H2SO4,加热至不再有气体生成,趁热过滤,洗涤固体,将滤液和洗涤液合并后转移至蒸发皿中备用,准确称量剩余固体质量得m2 g。
步骤三:计算所得FeSO4的物质的量,计算等物质的量的(NH4)2SO4固体的质量,准确称取(NH4)2SO4。
步骤四:将(NH4)2SO4固体加入蒸发皿中,缓慢加热浓缩至表面出现结晶薄膜为止,放置冷却。
步骤五:经过一系列操作,最终得到较纯净的(NH4)2FeSO4·6H2O。
(1)N、O、H三种元素的第一电离能由大到小的顺序为
(2)步骤一中加入10% Na2CO3溶液,小火加热30分钟的目的是
(3)关于步骤五中的一系列操作的相关表述,错误的是___________(填字母)。
| A.过滤时可使用玻璃棒搅拌的方式来缩短时间 |
| B.过滤和洗涤的速度都要尽可能的快,可以减少产品的氧化 |
| C.洗涤时使用无水乙醇既可以洗去晶体表面的杂质离子,又可以起到干燥作用 |
| D.所得的产品可以采取电热炉烘干的方式彻底干燥 |
II.硫酸亚铁铵的分解
已知硫酸亚铁铵在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500 ℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。

(4)B装置的作用是
(5)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定分解产物中的某种气体,写出D中发生反应的离子方程式
(6)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3而不含FeO。其预期实验现象为:
| 实验步骤 | 预期现象 | 结论 |
| ①取少量A中残留物于试管中,加入适量稀硫酸,充分振荡便其完全溶解; ②将溶液分成两份,分别滴加高锰酸钾溶液、KSCN溶液 | ___________ | 固体残留物仅为Fe2O3 |
您最近一年使用:0次
2023-05-16更新
|
405次组卷
|
3卷引用:湖南省岳阳市平江县2023届高三下学期教学质量监测(三)化学试题



