解题方法
1 . 已知A、B、C、D是原子序数依次减小的四种短周期元素,C的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;A原子有2个未成对电子;A、C、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E是第四周期元素,其原子核外最外层电子数与D原子相同,其余各层电子均充满。
请回答下列问题(用元素符号或化学式表示):
(1)元素B、C、A的基态原子的第一电离能由大到小的顺序为__________________ ;
(2)M分子中C原子轨道的杂化类型为__________________ ;
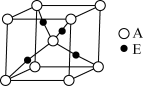
(3)E+的核外电子排布式为__________________ ,下图是由D、E形成的某种化合物的晶胞结构示意图,该化合物的化学式为__________________ ;
(4)化合物BD3的沸点比化合物CA4的高,其主要原因是__________________ ;
(5)写出与CA2互为等电子体的B3-的结构式__________________ ;
(6)将CrCl3·6H2O溶解在适量水中得到深绿色溶液,溶液中Cr3+以[Cr(H2O)5Cl]2+形式存在。上述溶液中,不存在的微粒间作用力是__________________ (填标号)。
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
请回答下列问题(用元素符号或化学式表示):
(1)元素B、C、A的基态原子的第一电离能由大到小的顺序为
(2)M分子中C原子轨道的杂化类型为
(3)E+的核外电子排布式为

(4)化合物BD3的沸点比化合物CA4的高,其主要原因是
(5)写出与CA2互为等电子体的B3-的结构式
(6)将CrCl3·6H2O溶解在适量水中得到深绿色溶液,溶液中Cr3+以[Cr(H2O)5Cl]2+形式存在。上述溶液中,不存在的微粒间作用力是
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
您最近一年使用:0次
2016-12-09更新
|
85次组卷
|
2卷引用:西藏林芝市第二高级中学2018-2019学年高二下学期期末考试理综化学试题



