名校
1 . 乙炔( )、丙烯腈(
)、丙烯腈( )、乙烯酮(
)、乙烯酮(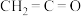 )是有机合成工业的重要原料。工业上曾用
)是有机合成工业的重要原料。工业上曾用 和
和 反应制取乙炔,用乙炔和氢氰酸(HCN)在氯化亚铜等催化作用下生产丙烯腈,乙炔与
反应制取乙炔,用乙炔和氢氰酸(HCN)在氯化亚铜等催化作用下生产丙烯腈,乙炔与 在一定条件下反应生成乙烯酮。回答下列问题:
在一定条件下反应生成乙烯酮。回答下列问题:
(1)写出基态钙原子的核外电子排布式:___________ ;Cu元素在元素周期表中的位置为___________ 。
(2)乙炔分子的空间结构为___________ ,乙炔分子属于___________ (填“极性”或“非极性”)分子。
(3)丙烯腈分子中碳原子的杂化轨道类型是___________ 。
(4)乙烯酮在室温下可聚合成二聚乙烯酮(结构简式为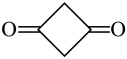 ),二聚乙烯酮分子中含有的
),二聚乙烯酮分子中含有的 键与
键与 键的数目之比为
键的数目之比为___________ 。
 )、丙烯腈(
)、丙烯腈( )、乙烯酮(
)、乙烯酮(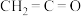 )是有机合成工业的重要原料。工业上曾用
)是有机合成工业的重要原料。工业上曾用 和
和 反应制取乙炔,用乙炔和氢氰酸(HCN)在氯化亚铜等催化作用下生产丙烯腈,乙炔与
反应制取乙炔,用乙炔和氢氰酸(HCN)在氯化亚铜等催化作用下生产丙烯腈,乙炔与 在一定条件下反应生成乙烯酮。回答下列问题:
在一定条件下反应生成乙烯酮。回答下列问题:(1)写出基态钙原子的核外电子排布式:
(2)乙炔分子的空间结构为
(3)丙烯腈分子中碳原子的杂化轨道类型是
(4)乙烯酮在室温下可聚合成二聚乙烯酮(结构简式为
 ),二聚乙烯酮分子中含有的
),二聚乙烯酮分子中含有的 键与
键与 键的数目之比为
键的数目之比为
您最近一年使用:0次
10-11高二下·福建厦门·期中
2 . 碳是组成物质种类最多的元素。
(1)碳元素在元素周期表中的位置是第____ 周期_______ 族。碳有 、
、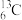 、
、 三种原子,它们互称为
三种原子,它们互称为___________________ 。
(2)金刚石、石墨、C60三种碳单质互称为___________________ 。C60的晶体类型是_________________ ,金刚石中碳原子的轨道杂化方式是_______ ,石墨晶体中存在的作用力有_______________________________________________ 。
(3)利用碳的低价氧化物CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为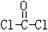 ,分子中C原子的杂化轨道方式是
,分子中C原子的杂化轨道方式是_____________ ;按原子轨道重叠方式判断COCl2分子中的化学键类型为___________________ 。
②Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断Fe(CO)5的晶体类型为_______________ ;Fe(CO)5在一定条件下发生分解反应:Fe(CO)5 =Fe(s)+5CO,反应过程中,断裂的化学键只有配位键。形成的化学键是_______________ 。
金属铁单质的晶体在不同温度下有两种堆积方式,晶胞如图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为_________ 。

(1)碳元素在元素周期表中的位置是第
 、
、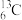 、
、 三种原子,它们互称为
三种原子,它们互称为(2)金刚石、石墨、C60三种碳单质互称为
(3)利用碳的低价氧化物CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为
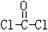 ,分子中C原子的杂化轨道方式是
,分子中C原子的杂化轨道方式是②Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断Fe(CO)5的晶体类型为
金属铁单质的晶体在不同温度下有两种堆积方式,晶胞如图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为

您最近一年使用:0次



