名校
1 . 硼的化合物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态硼原子的电子排布式为:___________ 。
(2) 和过量NaF作用可生成
和过量NaF作用可生成 ,
, 的空间结构为
的空间结构为___________ ; 的电子式为
的电子式为___________ 。
(3)正硼酸( )是一种片层状结构的白色晶体,层内的
)是一种片层状结构的白色晶体,层内的 分子通过氢键相连(如图)。下列有关说法正确的有___________。
分子通过氢键相连(如图)。下列有关说法正确的有___________。
(4)已知硼酸为一元弱酸,写出硼酸的电离方程式___________ 。
(5)硼砂是含结晶水的四硼酸钠。硼砂中阴离子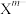 (含B、O、H三种元素)的球棍模型如图所示,则在
(含B、O、H三种元素)的球棍模型如图所示,则在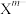 中,2号硼原子的杂化类型为
中,2号硼原子的杂化类型为___________ ;4号硼原子参与形成的化学键有___________ (填选项)。
m=___________ (填数字)。
(1)基态硼原子的电子排布式为:
(2)
 和过量NaF作用可生成
和过量NaF作用可生成 ,
, 的空间结构为
的空间结构为 的电子式为
的电子式为(3)正硼酸(
 )是一种片层状结构的白色晶体,层内的
)是一种片层状结构的白色晶体,层内的 分子通过氢键相连(如图)。下列有关说法正确的有___________。
分子通过氢键相连(如图)。下列有关说法正确的有___________。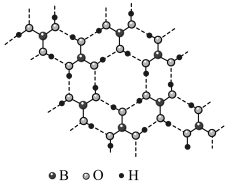
| A.正硼酸晶体属于共价晶体 | B.分子中硼原子最外层为8电子稳定结构 |
C. 分子的稳定性与氢键有关 分子的稳定性与氢键有关 | D.1mol  晶体中平均含3mol氢键 晶体中平均含3mol氢键 |
(4)已知硼酸为一元弱酸,写出硼酸的电离方程式
(5)硼砂是含结晶水的四硼酸钠。硼砂中阴离子
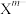 (含B、O、H三种元素)的球棍模型如图所示,则在
(含B、O、H三种元素)的球棍模型如图所示,则在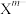 中,2号硼原子的杂化类型为
中,2号硼原子的杂化类型为 
m=
您最近半年使用:0次
名校
2 . 钛能与卤素单质发生反应,生成用途多样的卤化钛。
(1)卤族元素(F、Cl、Br、I)随着原子序数的递增,相关性质逐渐增强或变大的是___________。
(2) 易与
易与 结合,下列关于
结合,下列关于 分子说法错误的是___________。
分子说法错误的是___________。
(1)卤族元素(F、Cl、Br、I)随着原子序数的递增,相关性质逐渐增强或变大的是___________。
| A.元素的电负性 | B.简单离子的还原性 |
| C.气态氢化物的热稳定性 | D.最高价氧化物对应水化物的酸性 |
 易与
易与 结合,下列关于
结合,下列关于 分子说法错误的是___________。
分子说法错误的是___________。A.键角为 | B.是极性分子 |
C.含有 键 键 | D.中心原子采取 杂化 杂化 |
您最近半年使用:0次
名校
解题方法
3 . 回答下列问题
(1) 分子的中心原子的杂化类型
分子的中心原子的杂化类型___________ 。
(2) 分子中共价键的类型分别是_______。
分子中共价键的类型分别是_______。
(1)
 分子的中心原子的杂化类型
分子的中心原子的杂化类型(2)
 分子中共价键的类型分别是_______。
分子中共价键的类型分别是_______。A. 键、非极性健 键、非极性健 | B. 键、极性键 键、极性键 |
C. 键、非极性键 键、非极性键 | D. 键、极性键 键、极性键 |
您最近半年使用:0次
名校
解题方法
4 . 硫元素能形成多种微粒如 、
、 、
、 、
、 、
、 等,
等, 分子的立体构型为
分子的立体构型为___________ , 的中心原子的杂化类型是
的中心原子的杂化类型是___________ 。
 、
、 、
、 、
、 、
、 等,
等, 分子的立体构型为
分子的立体构型为 的中心原子的杂化类型是
的中心原子的杂化类型是
您最近半年使用:0次
名校
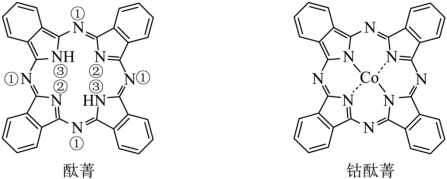
5 . 酞菁和钴酞菁的分子结构如图所示。___________ (填图酞菁中N原子的标号)。钴酞菁分子中,钴离子的化合价为___________ ,氮原子提供孤对电子与钴离子形成___________ 键。
(2)气态 通常以二聚体
通常以二聚体 的形式存在,其空间结构如图a所示,二聚体中Al的轨道杂化类型为
的形式存在,其空间结构如图a所示,二聚体中Al的轨道杂化类型为___________ 。 的熔点为
的熔点为 ,远高于
,远高于 的
的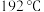 ,由此可以判断铝氟之间的化学键为
,由此可以判断铝氟之间的化学键为___________ 键。 结构属立方晶系,晶胞如图b所示,F-的配位数为
结构属立方晶系,晶胞如图b所示,F-的配位数为___________ 。
(2)气态
 通常以二聚体
通常以二聚体 的形式存在,其空间结构如图a所示,二聚体中Al的轨道杂化类型为
的形式存在,其空间结构如图a所示,二聚体中Al的轨道杂化类型为 的熔点为
的熔点为 ,远高于
,远高于 的
的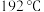 ,由此可以判断铝氟之间的化学键为
,由此可以判断铝氟之间的化学键为 结构属立方晶系,晶胞如图b所示,F-的配位数为
结构属立方晶系,晶胞如图b所示,F-的配位数为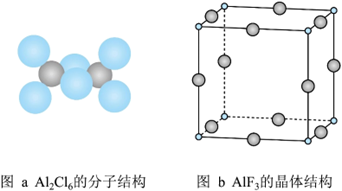
您最近半年使用:0次
名校
6 . 卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)氟原子在不同状态下的电子排布式有以下几种,其中处于激发态且能量较高的是___________ 。(填标号)
a. b.
b. c.
c. d.
d.
(2)①一氯乙烯(C2H3Cl)分子中,C的一个___________ 杂化轨道与Cl的3px轨道形成C-Cl___________ 键,并且Cl的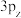 轨道与C的
轨道与C的 轨道形成3中心4电子的大π键
轨道形成3中心4电子的大π键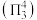 。
。
②一氯乙烷(C2H5Cl)、一氯乙烯(C2H3Cl)、一氯乙炔(C2HCl)分子中,C-Cl键长的顺序是___________ ,理由:(ⅰ)C的杂化轨道中s成分越多,形成的C-Cl键越强;(ⅱ)___________ 。
(1)氟原子在不同状态下的电子排布式有以下几种,其中处于激发态且能量较高的是
a.
 b.
b. c.
c. d.
d.
(2)①一氯乙烯(C2H3Cl)分子中,C的一个
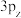 轨道与C的
轨道与C的 轨道形成3中心4电子的大π键
轨道形成3中心4电子的大π键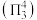 。
。②一氯乙烷(C2H5Cl)、一氯乙烯(C2H3Cl)、一氯乙炔(C2HCl)分子中,C-Cl键长的顺序是
您最近半年使用:0次
名校
解题方法
7 . 回答下列问题。
(1)基态B原子核外电子有___________ 种运动状态。
(2)基态铜原子的电子排布式是___________ ;高温超导材料镧钡铜氧化物中含有Cu3+。基态时Cu3+ 的电子排布式为[Ar]___________ 。
(3)Fe4[Fe(CN)6]3是较早发现的CN- 配合物,其中铁元素呈现两种不同的价态。配离子的中心原子核外电子排布式为___________ 。
(4)[B(OH)4]-中氧原子的杂化轨道类型为___________ ,[B(OH)4]-的空间构型为___________ 。
(5)基态氧原子的价层电子排布式不能表示为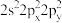 ,因为这违背了
,因为这违背了___________ (填选项)。
A.泡利原理 B.洪特规则 C.能量最低原理
(1)基态B原子核外电子有
(2)基态铜原子的电子排布式是
(3)Fe4[Fe(CN)6]3是较早发现的CN- 配合物,其中铁元素呈现两种不同的价态。配离子的中心原子核外电子排布式为
(4)[B(OH)4]-中氧原子的杂化轨道类型为
(5)基态氧原子的价层电子排布式不能表示为
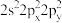 ,因为这违背了
,因为这违背了A.泡利原理 B.洪特规则 C.能量最低原理
您最近半年使用:0次
名校
8 . 硅材料在生活中占有重要地位。请回答:
(1)Si原子结构示意图为__________ , 受热分解生成
受热分解生成 和
和 ,
, 空间结构名称为
空间结构名称为__________ 。
(2)在硅酸盐中, 四面体(如下图(a))中Si原子的杂化形式为
四面体(如下图(a))中Si原子的杂化形式为__________ 。 通过共用顶角氧离子可形成链状结构型式。图(b)为一种无限长双链结构多硅酸根,Si与O的原子数之比为
通过共用顶角氧离子可形成链状结构型式。图(b)为一种无限长双链结构多硅酸根,Si与O的原子数之比为__________ 。
(1)Si原子结构示意图为
 受热分解生成
受热分解生成 和
和 ,
, 空间结构名称为
空间结构名称为(2)在硅酸盐中,
 四面体(如下图(a))中Si原子的杂化形式为
四面体(如下图(a))中Si原子的杂化形式为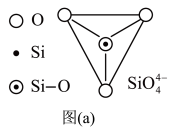
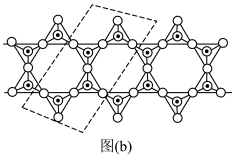
 通过共用顶角氧离子可形成链状结构型式。图(b)为一种无限长双链结构多硅酸根,Si与O的原子数之比为
通过共用顶角氧离子可形成链状结构型式。图(b)为一种无限长双链结构多硅酸根,Si与O的原子数之比为
您最近半年使用:0次
名校
9 . 硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
(1)基态硒原子的价层电子排布式为___________ ;As的第一电离能比Se的第一电离能大的原因为___________ 。
(2) 中心原子的杂化类型是:
中心原子的杂化类型是:___________ , 的立体构型是
的立体构型是___________ 。
(3) 属于
属于___________ (填“极性”或“非极性”)分子;比较 与
与 沸点高低,并说明原因:
沸点高低,并说明原因:___________ 。
(4)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为___________ ;若该晶胞密度为ρg⋅cm ,硒化锌的摩尔质量为Mg⋅mol
,硒化锌的摩尔质量为Mg⋅mol ,
, 代表阿伏加德罗常数的值,则晶胞参数(边长)a为
代表阿伏加德罗常数的值,则晶胞参数(边长)a为___________ 。
(1)基态硒原子的价层电子排布式为
(2)
 中心原子的杂化类型是:
中心原子的杂化类型是: 的立体构型是
的立体构型是(3)
 属于
属于 与
与 沸点高低,并说明原因:
沸点高低,并说明原因:(4)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为
 ,硒化锌的摩尔质量为Mg⋅mol
,硒化锌的摩尔质量为Mg⋅mol ,
, 代表阿伏加德罗常数的值,则晶胞参数(边长)a为
代表阿伏加德罗常数的值,则晶胞参数(边长)a为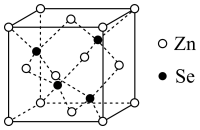
您最近半年使用:0次
10 . 砷化镍可用于制作发光器件、半导体激光器、太阳能电池和高速集成电路。
(1)第一电离能:As___________ (填“>”或“<”)Se.
(2)As2O3是两性氧化物,As2O3溶于盐酸生成AsCl3,AsCl3用LiAlH4还原生成AsH3。___________ (填“>”“=”或“<”)109°28′。
(3)有机砷 是治疗昏睡病的药物,它存在的化学键种类有
是治疗昏睡病的药物,它存在的化学键种类有___________ (填字母)。
a.离子键 b.σ键
c.π键 d.碳碳双键
(4)氮与砷同族,氮元素是植物生长所需的元素,常见氮肥有铵盐(NH )、尿素(
)、尿素(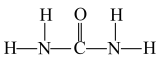 )等,NH
)等,NH 中H—N—H的键角
中H—N—H的键角___________ (填“>”“<”“=”)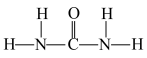 中N—C—N的键角;1 mol尿素分子含有σ键的数目为
中N—C—N的键角;1 mol尿素分子含有σ键的数目为___________ 。
(1)第一电离能:As
(2)As2O3是两性氧化物,As2O3溶于盐酸生成AsCl3,AsCl3用LiAlH4还原生成AsH3。
①AlH 的中心原子的杂化方式为
的中心原子的杂化方式为
(3)有机砷
 是治疗昏睡病的药物,它存在的化学键种类有
是治疗昏睡病的药物,它存在的化学键种类有a.离子键 b.σ键
c.π键 d.碳碳双键
(4)氮与砷同族,氮元素是植物生长所需的元素,常见氮肥有铵盐(NH
 )、尿素(
)、尿素(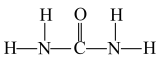 )等,NH
)等,NH 中H—N—H的键角
中H—N—H的键角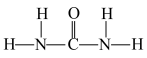 中N—C—N的键角;1 mol尿素分子含有σ键的数目为
中N—C—N的键角;1 mol尿素分子含有σ键的数目为
您最近半年使用:0次



