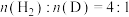名校
解题方法
1 . 钛,铬,铁,镍、铜等金属及其化合物在工业上有重要用途。
(1)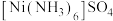 中
中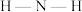 的键角
的键角_______ (填“>”或“<”) 中
中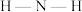 的键角,原因是
的键角,原因是_______
(2)元素铜与镍的第二电离能分别为: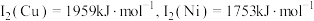 ,则
,则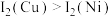 的原因是
的原因是_______
(3)某含铁物质的结构如图所示,图中“Fe”代表 ,则
,则 与氮原子之间形成的化学键的类型是
与氮原子之间形成的化学键的类型是_______ (填“配位键”或“离子键”)。基态 和
和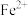 中未成对电子数之比为
中未成对电子数之比为_______ 。 )具有很强的储氢能力,其晶胞结构如图,其中
)具有很强的储氢能力,其晶胞结构如图,其中
_______ 。已知晶胞体积为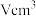 ,若储氢后形成
,若储氢后形成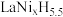 (H进入晶胞空隙,晶胞体积不变),
(H进入晶胞空隙,晶胞体积不变), 为阿伏加德罗常数的值,则氢元素在合金中的密度为
为阿伏加德罗常数的值,则氢元素在合金中的密度为_______ 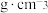 (用含V、
(用含V、 的代数式表示)。
的代数式表示)。
(1)
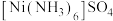 中
中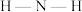 的键角
的键角 中
中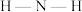 的键角,原因是
的键角,原因是(2)元素铜与镍的第二电离能分别为:
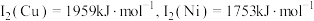 ,则
,则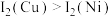 的原因是
的原因是(3)某含铁物质的结构如图所示,图中“Fe”代表
 ,则
,则 与氮原子之间形成的化学键的类型是
与氮原子之间形成的化学键的类型是 和
和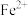 中未成对电子数之比为
中未成对电子数之比为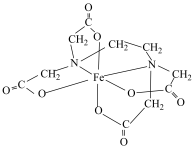
 )具有很强的储氢能力,其晶胞结构如图,其中
)具有很强的储氢能力,其晶胞结构如图,其中
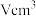 ,若储氢后形成
,若储氢后形成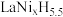 (H进入晶胞空隙,晶胞体积不变),
(H进入晶胞空隙,晶胞体积不变), 为阿伏加德罗常数的值,则氢元素在合金中的密度为
为阿伏加德罗常数的值,则氢元素在合金中的密度为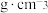 (用含V、
(用含V、 的代数式表示)。
的代数式表示)。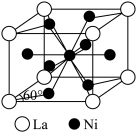
您最近半年使用:0次
2 . 一种天然二十面体准晶颗粒由Al、Ca、Cu、Fe四种金属元素组成。请回答下列问题:
(1)基态铁原子的核外电子排布式为_______ ,从结构角度来看,Fe2+易被氧化成Fe3+的原因是_______ 。
(2)SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①硫氰酸分子中硫原子的杂化方式为_______ 。
②异硫氰酸的沸点比硫氰酸高的原因是_______ 。
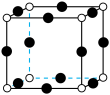
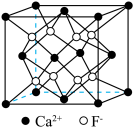
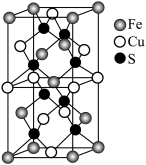
(3)AlF3的熔点为1090℃,远高于AlCl3的熔点192℃,原因为_______ 。AlF3结构属立方晶系,其晶胞如图1所示,F的配位数为_______ 。_______ cm(用含有ρ、NA的代数式表示)。_______ ;若晶胞的底面边长为apm,高为bpm,阿伏加德罗常数为NA,则该晶体的密度为_______ g·cm-3(用含有a、b、NA的代数式表示)。
(1)基态铁原子的核外电子排布式为
(2)SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①硫氰酸分子中硫原子的杂化方式为
②异硫氰酸的沸点比硫氰酸高的原因是
(3)AlF3的熔点为1090℃,远高于AlCl3的熔点192℃,原因为
您最近半年使用:0次
3 . 下表中A、B、C、D、E为原子序数依次增大的短周期主族元素,F、G为第四周期元素,其相关信息如下:
(1)E元素在周期表中的位置是___________ ,其基态原子最高能层的电子占据的原子轨道电子云为_____________ 形。
(2)F元素位于元素周期的_____________ 区,其基态原子的价层电子轨道表示式为______________ 。
(3)C元素单质的结构式为_____________ ,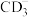 中心原子的杂化方式为
中心原子的杂化方式为___________ ,分子空间构型为_______________ 。
(4)B、C、D、E四种元素的原子半径由大到小的顺序:____________ (填元素符号)。
(5)气态F2+比气态G2+再失去一个电子难,原因是____________ 。
(6)下列关于B2A4的说法中正确的是____________(填序号)。
| A.元素原子是元素周期表中半径最小的原子 |
| B.基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| C.元素原子最高能级的不同轨道都有电子,且只有一种自旋方向 |
| D.原子核外s能级上的电子总数与p能级上的电子总数相等 |
| E.与D为同主族元素 |
| F.其+2价离子的3d轨道为半充满状态 |
| G.目前年产量最大、使用最广泛的金属 |
(2)F元素位于元素周期的
(3)C元素单质的结构式为
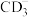 中心原子的杂化方式为
中心原子的杂化方式为(4)B、C、D、E四种元素的原子半径由大到小的顺序:
(5)气态F2+比气态G2+再失去一个电子难,原因是
(6)下列关于B2A4的说法中正确的是____________(填序号)。
| A.B2A4分子中中心原子的杂化类型为sp2 |
| B.B2A4是只由极性键形成的非极性分子 |
| C.B2A4中的所有原子都满足8电子稳定结构 |
| D.B2A4分子中σ键和π键数目比为5:1 |
您最近半年使用:0次
4 . 千金藤素常用于防治肿瘤病患者白细胞减少症、抗疟疾、调节免疫功能等,制备其关键中间体(I)的一种合成路线如下:
(1)化合物A的名称为______ ;化合物C中含有的官能团名称为___________ 。
(2)反应②是原子利用率100%的反应,写出化合物ⅰ的一种用途________________ 。
(3)芳香化合物x为ⅱ的同分异构体,能发生水解反应,且核磁共振氢谱中4组峰的面积之比为6∶2∶1∶1。x的结构简式为_____________________ (写出一种)。
(4)根据化合物D的结构特征,分析预测其主要的化学性质,完成下表。
(5)下列说法正确的是
(6)参照上述路线,以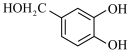 、ⅲ(一种二溴代烃)为主要原料合成流程中的物质H,基于你的设计,回答下列问题:
、ⅲ(一种二溴代烃)为主要原料合成流程中的物质H,基于你的设计,回答下列问题:
①原料ⅲ为_____________ (写结构简式)。
②相关步骤涉及芳香醇转化为芳香醛的反应,对应的化学方程式为_____________________ 。
③最后一步反应类型为____________ 。
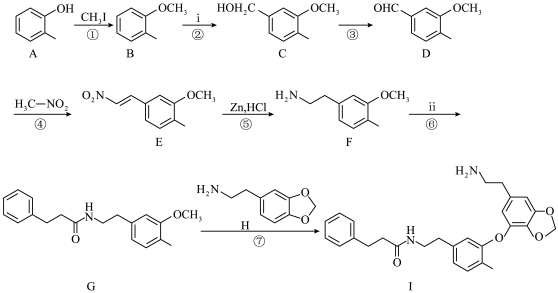
(1)化合物A的名称为
(2)反应②是原子利用率100%的反应,写出化合物ⅰ的一种用途
(3)芳香化合物x为ⅱ的同分异构体,能发生水解反应,且核磁共振氢谱中4组峰的面积之比为6∶2∶1∶1。x的结构简式为
(4)根据化合物D的结构特征,分析预测其主要的化学性质,完成下表。
序号 | 可反应的试剂 | 反应形成的新结构 | 消耗反应物的物质的量之比 |
① | 新制 | 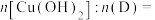 | |
② |
|
|
(5)下列说法正确的是
A.有机物A碳原子杂化方式有 、 、 | B.反应①,有C-I键和H-O键断裂 |
C.1mol化合物B中,含 键16 键16 个 个 | D.产品I属于极性分子,易溶于水和酒精 |
(6)参照上述路线,以
 、ⅲ(一种二溴代烃)为主要原料合成流程中的物质H,基于你的设计,回答下列问题:
、ⅲ(一种二溴代烃)为主要原料合成流程中的物质H,基于你的设计,回答下列问题:①原料ⅲ为
②相关步骤涉及芳香醇转化为芳香醛的反应,对应的化学方程式为
③最后一步反应类型为
您最近半年使用:0次
名校
解题方法
5 . 铁及其化合物广泛地应用到各个领域。回答下列问题:
(1)铁元素位于元素周期表的___________ 区。
(2)我国菱铁矿 储量较为丰富,
储量较为丰富, 中
中 的空间结构为
的空间结构为___________ 。
(3)草酸亚铁可作为电池正极材料磷酸铁锂的原料,其结构简式如下,碳原子的杂化方式是___________ 。 溶于汽油、苯、丙酮等有机溶剂。CO与Fe之间从电子对给予来看形成
溶于汽油、苯、丙酮等有机溶剂。CO与Fe之间从电子对给予来看形成___________ 键。
(5)以 、
、 合成
合成 ,Fe是常用的催化剂。实际生产中采用铁的氧化物
,Fe是常用的催化剂。实际生产中采用铁的氧化物 、FeO,使用前用
、FeO,使用前用 和
和 的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为立方体)结构示意如下,两种晶胞所含铁原子个数比为
的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为立方体)结构示意如下,两种晶胞所含铁原子个数比为___________ 。___________ 。若该晶体的密度是d g⋅cm ,则两个最近的Fe原子间的距离为
,则两个最近的Fe原子间的距离为___________ nm(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)铁元素位于元素周期表的
(2)我国菱铁矿
 储量较为丰富,
储量较为丰富, 中
中 的空间结构为
的空间结构为(3)草酸亚铁可作为电池正极材料磷酸铁锂的原料,其结构简式如下,碳原子的杂化方式是
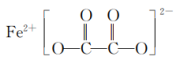
 溶于汽油、苯、丙酮等有机溶剂。CO与Fe之间从电子对给予来看形成
溶于汽油、苯、丙酮等有机溶剂。CO与Fe之间从电子对给予来看形成(5)以
 、
、 合成
合成 ,Fe是常用的催化剂。实际生产中采用铁的氧化物
,Fe是常用的催化剂。实际生产中采用铁的氧化物 、FeO,使用前用
、FeO,使用前用 和
和 的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为立方体)结构示意如下,两种晶胞所含铁原子个数比为
的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为立方体)结构示意如下,两种晶胞所含铁原子个数比为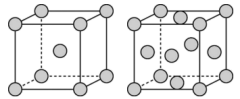
 ,则两个最近的Fe原子间的距离为
,则两个最近的Fe原子间的距离为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。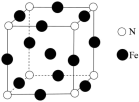
您最近半年使用:0次
名校
解题方法
6 . 碱金属及其化合物在科学研究、生产生活中有广泛应用。请回答下列问题:
(1)基态钠原子核外电子占据能级数为________ ,核外电子共有________ 种不同的运动状态。
(2)与K同周期的元素中,最外层电子数与K相同的为________ (写元素符号)。
(3)在同周期元素中,碱金属元素的________ (填“电负性”“原子半径”或“第一电离能”)最小。
(4)氢化钠晶胞类似氯化钠晶胞(晶胞结构如图1所示)。设氢化钠晶体中钠离子半径为 ,氢离子半径为
,氢离子半径为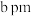 ,并且它们在晶体中紧密堆积,则氢化钠晶胞中离子的空间利用率为
,并且它们在晶体中紧密堆积,则氢化钠晶胞中离子的空间利用率为________ 。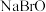 、
、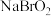 、
、 、
、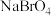 四种钠盐中,Br的杂化方式均为
四种钠盐中,Br的杂化方式均为________ 。
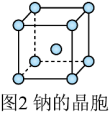
(6)钠晶胞结构如图2所示,配位数为________ 。若钠晶胞的边长为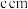 ,
, 代表阿伏加德罗常数的值,则钠晶体的密度为
代表阿伏加德罗常数的值,则钠晶体的密度为________  。
。
(1)基态钠原子核外电子占据能级数为
(2)与K同周期的元素中,最外层电子数与K相同的为
(3)在同周期元素中,碱金属元素的
(4)氢化钠晶胞类似氯化钠晶胞(晶胞结构如图1所示)。设氢化钠晶体中钠离子半径为
 ,氢离子半径为
,氢离子半径为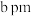 ,并且它们在晶体中紧密堆积,则氢化钠晶胞中离子的空间利用率为
,并且它们在晶体中紧密堆积,则氢化钠晶胞中离子的空间利用率为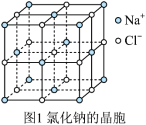
 、
、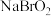 、
、 、
、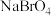 四种钠盐中,Br的杂化方式均为
四种钠盐中,Br的杂化方式均为(6)钠晶胞结构如图2所示,配位数为
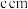 ,
, 代表阿伏加德罗常数的值,则钠晶体的密度为
代表阿伏加德罗常数的值,则钠晶体的密度为 。
。
您最近半年使用:0次
名校
解题方法
7 . 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]________ ,有________ 个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是__________________ 。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因___________________ 。
(4)光催化还原 制备
制备 反应中,带状纳米
反应中,带状纳米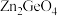 是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是
是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________________ 。
(5) 分子的空间构形为
分子的空间构形为________ ,其中Ge原子的杂化方式为________ 。
(1)基态Ge原子的核外电子排布式为[Ar]
(2)Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因
 | 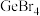 | 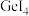 | |
| 熔点/℃ | 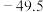 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
 制备
制备 反应中,带状纳米
反应中,带状纳米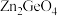 是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是
是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是(5)
 分子的空间构形为
分子的空间构形为
您最近半年使用:0次
2024高三·全国·专题练习
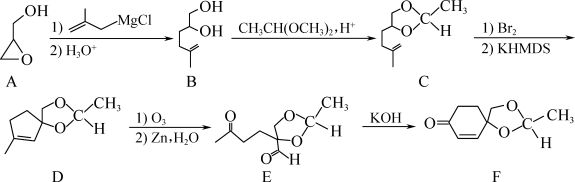
8 . 化合物F是一种药物中间体,其合成路线如下:___________ 。
(2)E→F分两步进行,反应类型依次为___________ 、消去反应。
(3)A→B的反应过程中会产生一种与B互为同分异构体的副产物,则该副产物的结构简式为___________ 。
(4)F的一种同分异构体同时满足下列条件,写出其结构简式:___________ 。
①分子中含有苯环;②分子中含有3种化学环境不同的氢原子。
(5)设计以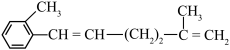 为原料制备
为原料制备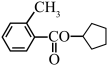 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。___________
(2)E→F分两步进行,反应类型依次为
(3)A→B的反应过程中会产生一种与B互为同分异构体的副产物,则该副产物的结构简式为
(4)F的一种同分异构体同时满足下列条件,写出其结构简式:
①分子中含有苯环;②分子中含有3种化学环境不同的氢原子。
(5)设计以
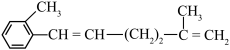 为原料制备
为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
您最近半年使用:0次
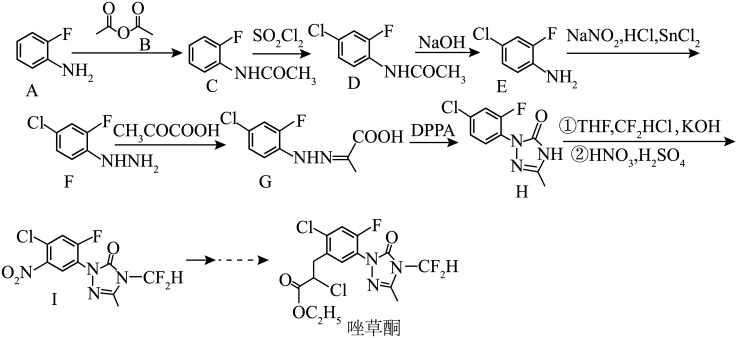
9 . 唑草酮是一种药性强、易降解、污染少的除草剂,其中一种合成路线为:
(1) 和
和 中含氮官能团的名称为
中含氮官能团的名称为_______ ; 反应的反应类型为
反应的反应类型为_______ 。
(2)A与 反应生成
反应生成 的化学方程式为
的化学方程式为_______ ;该反应的目的是_______ 。
(3)苯胺中的氮原子含有孤对电子,这些电子可以与质子 结合,形成阳离子,从而使其呈现碱性。已知
结合,形成阳离子,从而使其呈现碱性。已知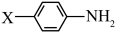 中
中 键极性越大,则碱性越弱,则下列物质的碱性最强的为
键极性越大,则碱性越弱,则下列物质的碱性最强的为_______ (填标号)。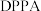 是一种叠氮化试剂,结构如图,其中发生杂化的
是一种叠氮化试剂,结构如图,其中发生杂化的 原子的杂化轨道类型为
原子的杂化轨道类型为_______ 。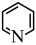 )和苯在结构上非常相似,都存在
)和苯在结构上非常相似,都存在 。
。 的同分异构体中符合下列条件的有
的同分异构体中符合下列条件的有_______ 种(不考虑立体异构)。
(6)参照如图合成路线,设计以苯胺( )为原料合成
)为原料合成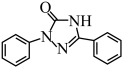 的路线
的路线_______ (无机、有机试剂任选)。
(1)
 和
和 中含氮官能团的名称为
中含氮官能团的名称为 反应的反应类型为
反应的反应类型为(2)A与
 反应生成
反应生成 的化学方程式为
的化学方程式为(3)苯胺中的氮原子含有孤对电子,这些电子可以与质子
 结合,形成阳离子,从而使其呈现碱性。已知
结合,形成阳离子,从而使其呈现碱性。已知 中
中 键极性越大,则碱性越弱,则下列物质的碱性最强的为
键极性越大,则碱性越弱,则下列物质的碱性最强的为a. b.
b. 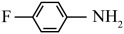 c.
c.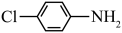
 是一种叠氮化试剂,结构如图,其中发生杂化的
是一种叠氮化试剂,结构如图,其中发生杂化的 原子的杂化轨道类型为
原子的杂化轨道类型为
 )和苯在结构上非常相似,都存在
)和苯在结构上非常相似,都存在 。
。 的同分异构体中符合下列条件的有
的同分异构体中符合下列条件的有①分子骨架为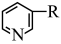 ,且
,且 结构中含有一个“
结构中含有一个“ ”和一个“
”和一个“ ”
”
(6)参照如图合成路线,设计以苯胺(
 )为原料合成
)为原料合成 的路线
的路线
您最近半年使用:0次
10 . ZnO在化学工业中主要用作橡胶和颜料的添加剂,医药上用于制软膏、橡皮膏等。工业上可由菱锌矿(主要成分为ZnCO3,还含有Ni、Cd、Fe、Mn等元素)制备。工艺如图所示:
已知:①“溶浸”后的溶液中金属离子主要有:Zn2+、Fe2+、Cd2+、Mn2+、Ni2+。
②弱酸性溶液中KMnO4能将Mn2+氧化生成MnO2。
③氧化性顺序:Ni2+>Cd2+>Zn2+。
(1)基态Zn原子的核外电子排布式为___________ ,铁在元素周期表中的位置为___________ ,Ni2+和Fe2+可形成如图所示的配合物离子,其中铁的一个配体为茂环阴离子(C5H ),该配体以π电子参与配位,配合物离子中与铁形成配位键的电子共有
),该配体以π电子参与配位,配合物离子中与铁形成配位键的电子共有___________ 个,S元素的杂化方式为___________ 。 ”是向“溶浸”后的溶液中加入少量
”是向“溶浸”后的溶液中加入少量___________ (填化学式)调节至弱酸性(pH为5.5)。此时溶液中 的最大浓度是
的最大浓度是___________ 。
(3)加 “氧化除杂”发生反应的离子方程式分别是
“氧化除杂”发生反应的离子方程式分别是 和
和___________ 。
(4)“还原除杂”除去的离子是___________ 。
(5)生成碱式碳酸锌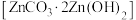 沉淀,写出该步骤的离子方程式
沉淀,写出该步骤的离子方程式___________ 。碱式碳酸锌灼烧后得到ZnO,ZnO的一种晶体的晶胞是立方晶胞(如图所示),晶胞参数为apm,该晶胞的密度为___________ g/cm3,请在图中画出该晶胞沿 轴方向的平面投影图
轴方向的平面投影图___________ 。

| 金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ | Mn2+ | Ni2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.0 | 7.4 | 8.1 | 6.9 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.0 | 9.4 | 10.1 | 8.9 |
②弱酸性溶液中KMnO4能将Mn2+氧化生成MnO2。
③氧化性顺序:Ni2+>Cd2+>Zn2+。
(1)基态Zn原子的核外电子排布式为
 ),该配体以π电子参与配位,配合物离子中与铁形成配位键的电子共有
),该配体以π电子参与配位,配合物离子中与铁形成配位键的电子共有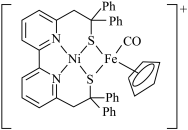
 ”是向“溶浸”后的溶液中加入少量
”是向“溶浸”后的溶液中加入少量 的最大浓度是
的最大浓度是(3)加
 “氧化除杂”发生反应的离子方程式分别是
“氧化除杂”发生反应的离子方程式分别是 和
和(4)“还原除杂”除去的离子是
(5)生成碱式碳酸锌
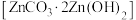 沉淀,写出该步骤的离子方程式
沉淀,写出该步骤的离子方程式 轴方向的平面投影图
轴方向的平面投影图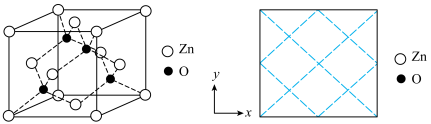
您最近半年使用:0次