名校
解题方法
1 . (一)我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排式为___________ ;单晶硅的晶体类型为___________ 。SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为___________ 。
(2)CO2分子中存在___________ 个 键和
键和___________ 个 键。
键。
(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是___________ 。
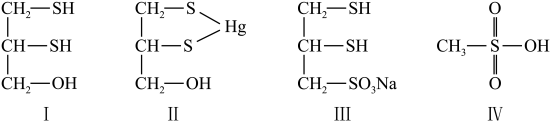
(二)很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。___________ 。
(5)H2S、CH4、H2O的沸点由高到低顺序为___________ 。
(6)汞的原子序数为80,位于元素周期表第___________ 周期第ⅡB族。
(7)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有___________ 。
A.在I中S原子采取sp3杂化 B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180° D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(8)汞解毒剂的水溶性好,有利于体内 重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是___________ 。
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排式为
(2)CO2分子中存在
 键和
键和 键。
键。(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是
(二)很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。
(5)H2S、CH4、H2O的沸点由高到低顺序为
(6)汞的原子序数为80,位于元素周期表第
(7)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有
A.在I中S原子采取sp3杂化 B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180° D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(8)汞解毒剂的水溶性好,有利于体内 重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是
您最近一年使用:0次
名校
2 . 卤族元素的单质和化合物在生产生活中有重要的用途。请回答:
(1)卤素元素位于元素周期表的___________ 区,溴原子的原子核外有___________ 种不同运动状态的电子,其M能层电子排布式为___________ 。
(2) 中心原子的杂化类型为
中心原子的杂化类型为___________ , 的空间构型为
的空间构型为___________ 。
(3)一定条件下 与
与 以物质的量之比为
以物质的量之比为 混舍得到一种固态离子化合物,其结构组成可能为:(a)
混舍得到一种固态离子化合物,其结构组成可能为:(a)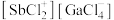 或(b)
或(b)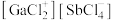 ,该离子化合物最可能的结构组成为
,该离子化合物最可能的结构组成为___________ (填“a”或“b”),理由是___________ 。
(4)在离子晶体中,当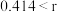 (阳离子)
(阳离子)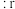 (阴离子)
(阴离子)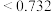 时,
时, 型化合物往往采用和
型化合物往往采用和 晶体相同的晶体结构(如下图1)。已知
晶体相同的晶体结构(如下图1)。已知 ,但在室温下,
,但在室温下, 的晶体结构如下图2所示,称为六方碘化银。
的晶体结构如下图2所示,称为六方碘化银。 的配位数为
的配位数为___________ ,造成 晶体结构不同于
晶体结构不同于 晶体结构的原因不可能是
晶体结构的原因不可能是___________ 。
a.几何因素 b.电荷因素 c.键性因素
若六方碘化银晶胞底边边长为 ,高为
,高为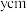 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,碘化银晶体的密度为
,碘化银晶体的密度为___________ 列出计算式。
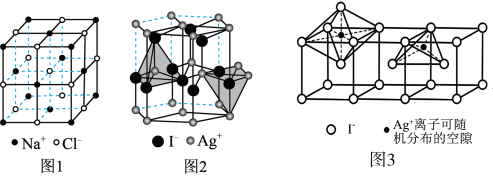
(5)当温度处于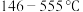 间时,六方碘化银转化为
间时,六方碘化银转化为 (如图3),
(如图3), 可随机地分布在四面体空隙和八面体空隙中,多面体空隙间又彼此共面相连,则在
可随机地分布在四面体空隙和八面体空隙中,多面体空隙间又彼此共面相连,则在 晶体中,
晶体中, (八面体空隙):n(四面体空隙)=
(八面体空隙):n(四面体空隙)=___________ 。
(1)卤素元素位于元素周期表的
(2)
 中心原子的杂化类型为
中心原子的杂化类型为 的空间构型为
的空间构型为(3)一定条件下
 与
与 以物质的量之比为
以物质的量之比为 混舍得到一种固态离子化合物,其结构组成可能为:(a)
混舍得到一种固态离子化合物,其结构组成可能为:(a)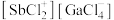 或(b)
或(b)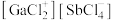 ,该离子化合物最可能的结构组成为
,该离子化合物最可能的结构组成为(4)在离子晶体中,当
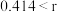 (阳离子)
(阳离子)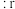 (阴离子)
(阴离子)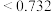 时,
时, 型化合物往往采用和
型化合物往往采用和 晶体相同的晶体结构(如下图1)。已知
晶体相同的晶体结构(如下图1)。已知 ,但在室温下,
,但在室温下, 的晶体结构如下图2所示,称为六方碘化银。
的晶体结构如下图2所示,称为六方碘化银。 的配位数为
的配位数为 晶体结构不同于
晶体结构不同于 晶体结构的原因不可能是
晶体结构的原因不可能是a.几何因素 b.电荷因素 c.键性因素
若六方碘化银晶胞底边边长为
 ,高为
,高为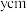 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,碘化银晶体的密度为
,碘化银晶体的密度为
(5)当温度处于
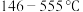 间时,六方碘化银转化为
间时,六方碘化银转化为 (如图3),
(如图3), 可随机地分布在四面体空隙和八面体空隙中,多面体空隙间又彼此共面相连,则在
可随机地分布在四面体空隙和八面体空隙中,多面体空隙间又彼此共面相连,则在 晶体中,
晶体中, (八面体空隙):n(四面体空隙)=
(八面体空隙):n(四面体空隙)=
您最近一年使用:0次
名校
解题方法
3 . BTCu是荧光增强型Cu2+荧光分子探针,可对环境和生物体内的微量Cu2+进行有效检测。BTCu识别Cu2+机理如下图:

回答下列问题:
(1)基态Cu原子的价电子排布式为___________ 。
(2)BTCu中所含第二周期元素的第一电离能由小到大的顺序为___________ (用元素符号表示)。
(3)探针BTCu与Cu2+的识别过程既有氧化脱氢反应,也有配合形式的参与。1molBTCu-Cu+中,Cu+形成的配位键有___________ mol,B原子的杂化轨道类型是___________ 。
(4)某晶体的晶胞结构如下图所示。已知:a=b=0.524 nm,c-1.032 nm,晶胞棱边夹角均为90°,NA为阿伏加德罗常数的值。(1nm=1×10-7cm)

①距离Fe最近且等距的S有___________ 个。
②该晶体的化学式是___________ 。
③该晶体的密度是___________ g/cm3 (列出计算式)。

回答下列问题:
(1)基态Cu原子的价电子排布式为
(2)BTCu中所含第二周期元素的第一电离能由小到大的顺序为
(3)探针BTCu与Cu2+的识别过程既有氧化脱氢反应,也有配合形式的参与。1molBTCu-Cu+中,Cu+形成的配位键有
(4)某晶体的晶胞结构如下图所示。已知:a=b=0.524 nm,c-1.032 nm,晶胞棱边夹角均为90°,NA为阿伏加德罗常数的值。(1nm=1×10-7cm)

①距离Fe最近且等距的S有
②该晶体的化学式是
③该晶体的密度是
您最近一年使用:0次
4 . 金属铜、铁在日常生活中应用广泛,根据下列说法回答下列问题。
(1) 的制备反应为
的制备反应为 。
。
上述氧化过程中, (II)
(II)_____ (答简化电子排布式)变为 III)
III)_____ (答外围电子排布图),基态 (III)电子占据
(III)电子占据_____ 个不同轨道。
(2)对上述反应式中的短周期元素按照电负性由小到大排序为_____
(3)配合物 的配位数为6,其配体
的配位数为6,其配体 中的
中的 的杂化方式为
的杂化方式为_____ 杂化。
(4)铜原子与氯原子形成化合物的晶胞如图所示(黑球代表铜原子,白球表示氯原子)。
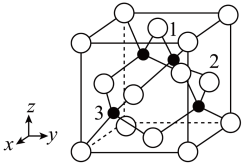
①已知铜和氯的电负性分别为1.9和3.0,则铜与氯形成的化合物属于_____ (填“离子”或“共价”)化合物。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1的坐标为( ,
, ,1),则原子2和3的坐标分别为
,1),则原子2和3的坐标分别为_____ 、_____ 。
③已知该晶体的密度为 ,阿伏加德罗常数为NA,则该晶体中铜原子和氯原子的最短距离为
,阿伏加德罗常数为NA,则该晶体中铜原子和氯原子的最短距离为_____ pm(只写计算式)。
(1)
 的制备反应为
的制备反应为 。
。上述氧化过程中,
 (II)
(II) III)
III) (III)电子占据
(III)电子占据(2)对上述反应式中的短周期元素按照电负性由小到大排序为
(3)配合物
 的配位数为6,其配体
的配位数为6,其配体 中的
中的 的杂化方式为
的杂化方式为(4)铜原子与氯原子形成化合物的晶胞如图所示(黑球代表铜原子,白球表示氯原子)。

①已知铜和氯的电负性分别为1.9和3.0,则铜与氯形成的化合物属于
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1的坐标为(
 ,
, ,1),则原子2和3的坐标分别为
,1),则原子2和3的坐标分别为③已知该晶体的密度为
 ,阿伏加德罗常数为NA,则该晶体中铜原子和氯原子的最短距离为
,阿伏加德罗常数为NA,则该晶体中铜原子和氯原子的最短距离为
您最近一年使用:0次
名校
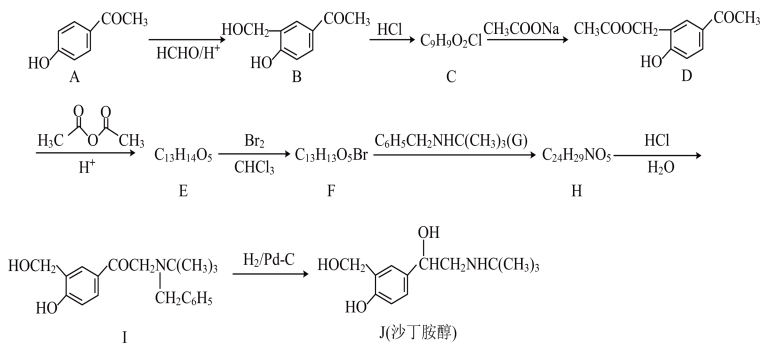
5 . 沙丁胺醇有明显的支气管舒张作用,临床上主要用于治疗喘息型支气管炎、支气管哮喘等,其中一条通用的合成路线如下:
已知:(1)R-OH ROOCCH3+CH3COOH (2)R-X+
ROOCCH3+CH3COOH (2)R-X+ →
→ +HX
+HX
请回答:
(1)A中官能团名称为___________ ,A中1molA 含δ键数为___________ NA。
(2)B→C的反应类型是___________ 。G中N原子的杂化方式___________ 。
(3)F→H的化学反应方程式为___________ 。
(4)E的结构简式为___________ ,设计D→E的目的是___________ 。
(5)写出同时满足下列条件的B的同分异构体的结构简式___________ 。(不考虑立体异构,只需写出2个)
①遇FeCl3溶液显紫色;②能发生银镜反应;③分子中有4种不同化学环境的H原子

已知:(1)R-OH
 ROOCCH3+CH3COOH (2)R-X+
ROOCCH3+CH3COOH (2)R-X+ →
→ +HX
+HX请回答:
(1)A中官能团名称为
(2)B→C的反应类型是
(3)F→H的化学反应方程式为
(4)E的结构简式为
(5)写出同时满足下列条件的B的同分异构体的结构简式
①遇FeCl3溶液显紫色;②能发生银镜反应;③分子中有4种不同化学环境的H原子
您最近一年使用:0次
解题方法
6 . 碳是一种很常见的元素,它能形成多种物质。
(1)碳与铁可以形成合金。
①基态碳原子的价电子排布图(即价电子轨道表示式)为___________ ;基态铁原子核外共有___________ 种不同空间运动状态的电子。
②从结构角度分析, 较
较 稳定的原因是
稳定的原因是___________ 。
(2)碳与其他元素一起能形成多种酸或酸根。
① 的空间构型是
的空间构型是___________ 。
②类卤素 分子中σ键与π键的数目比
分子中σ键与π键的数目比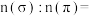
___________ 。 对应的酸有两种,理论上硫氰酸(
对应的酸有两种,理论上硫氰酸( )的沸点低于异硫氰酸(
)的沸点低于异硫氰酸(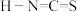 )的沸点,其原因是
)的沸点,其原因是___________ 。
(3)碳也可以形成多种有机化合物。
①有机物尿素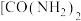 。尿素中C、N、O第一电离能大小顺序为
。尿素中C、N、O第一电离能大小顺序为___________ 。
②吡咯(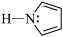 )结构中N原子的杂化轨道类型为
)结构中N原子的杂化轨道类型为___________ ;分子中的大π键可以用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为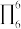 ),则吡咯中的大π键应表示为
),则吡咯中的大π键应表示为___________ 。
(4)碳还能形成多种同素异形体,如石墨、金刚石等。
①石墨具有平面层状结构,同一层中的原子构成许许多多的正六边形,它与熔融的K单质相互作用,形成某种青铜色的物质(其中的元素K用“●”表示),原子分布如图甲所示,该物质的化学式为___________ 。
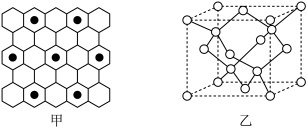
(图中的○表示碳形成的正四面体结构 )
)
②2017年,中外科学家团队共同合成了碳的一种新型同素异形体:T-碳。T-碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,可形成碳的一种新型三维立方晶体结构——T-碳(如图乙)。已知T-碳密度为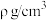 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则T-碳的晶胞参数
,则T-碳的晶胞参数
___________ pm(写出表达式即可)。
(1)碳与铁可以形成合金。
①基态碳原子的价电子排布图(即价电子轨道表示式)为
②从结构角度分析,
 较
较 稳定的原因是
稳定的原因是(2)碳与其他元素一起能形成多种酸或酸根。
①
 的空间构型是
的空间构型是②类卤素
 分子中σ键与π键的数目比
分子中σ键与π键的数目比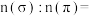
 对应的酸有两种,理论上硫氰酸(
对应的酸有两种,理论上硫氰酸( )的沸点低于异硫氰酸(
)的沸点低于异硫氰酸(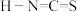 )的沸点,其原因是
)的沸点,其原因是(3)碳也可以形成多种有机化合物。
①有机物尿素
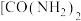 。尿素中C、N、O第一电离能大小顺序为
。尿素中C、N、O第一电离能大小顺序为②吡咯(
 )结构中N原子的杂化轨道类型为
)结构中N原子的杂化轨道类型为 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为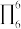 ),则吡咯中的大π键应表示为
),则吡咯中的大π键应表示为(4)碳还能形成多种同素异形体,如石墨、金刚石等。
①石墨具有平面层状结构,同一层中的原子构成许许多多的正六边形,它与熔融的K单质相互作用,形成某种青铜色的物质(其中的元素K用“●”表示),原子分布如图甲所示,该物质的化学式为

(图中的○表示碳形成的正四面体结构
 )
)②2017年,中外科学家团队共同合成了碳的一种新型同素异形体:T-碳。T-碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,可形成碳的一种新型三维立方晶体结构——T-碳(如图乙)。已知T-碳密度为
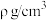 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则T-碳的晶胞参数
,则T-碳的晶胞参数
您最近一年使用:0次
名校
解题方法
7 . 某催化剂材料中包含了Fe、Cr、Ni、C等多种元素。回答下列问题:
(1)基态铁原子的价电子排布式为_______ 。
(2)与Cr同周期且基态原子最外层电子数相同的元素,可能位于周期表中的_______ 区。
(3)实验室常用KSCN溶液、苯酚(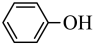 )检验Fe,其中N、O、S的第一电离能由大到小的顺序为
)检验Fe,其中N、O、S的第一电离能由大到小的顺序为_______ (用元素符号表示),苯酚中碳原子的杂化轨道类型为_______ 。
(4)铁元素能与CO形成五羰基铁[Fe(CO)5],Fe(CO)5可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含_______ molσ键,与CO互为等电子体的一种离子的化学式为_______ 。
(5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的_______ 空隙和_______ 空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0,0),B( ,0,
,0, ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为_______ 。
(6)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体中Ni2+与Ni3+的最简整数比为_______ ,晶胞参数为428pm,则晶体密度为_______ g/cm3(NA表示阿伏伽德罗常数的值,列出表达式)。

(1)基态铁原子的价电子排布式为
(2)与Cr同周期且基态原子最外层电子数相同的元素,可能位于周期表中的
(3)实验室常用KSCN溶液、苯酚(
 )检验Fe,其中N、O、S的第一电离能由大到小的顺序为
)检验Fe,其中N、O、S的第一电离能由大到小的顺序为(4)铁元素能与CO形成五羰基铁[Fe(CO)5],Fe(CO)5可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含
(5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的
 ,0,
,0, ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为(6)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体中Ni2+与Ni3+的最简整数比为

您最近一年使用:0次
解题方法
8 . “中国紫”——硅酸铜钡( ),其合成原料为
),其合成原料为 、孔雀石[
、孔雀石[ ]和砂子(
]和砂子( )。回答下列问题:
)。回答下列问题:
(1)基态Ba原子的价电子排布式为_______ 。
(2) 常用作光导纤维,在生产和生活中有广泛的用途。
常用作光导纤维,在生产和生活中有广泛的用途。
① 属于
属于_______ 晶体,在 晶体中,硅原子的杂化类型为
晶体中,硅原子的杂化类型为_______ , 的空间构型为
的空间构型为_______ 。
②1mol 晶体中,Si-O键的数目为
晶体中,Si-O键的数目为_______ 。
(3) 不溶于水,但可溶于浓氨水,反应的化学方程式为
不溶于水,但可溶于浓氨水,反应的化学方程式为
 。
。
①氨水中存在的化学键有_______ (填标号)。
A.极性键 B.非极性键 C.氢键 D.σ键 E.π键
② 中配体是
中配体是_______ ,所含元素中电负性最小的非金属元素是_______ (填元素符号)。
(4) 的熔点比
的熔点比 的
的_______ (填“高”或“低”),原因是_______ 。
(5)Cu和Ba形成的某种合金的晶胞结构如图所示,设 为阿伏加德罗常数的值,晶胞参数为a nm,则该晶体的密度
为阿伏加德罗常数的值,晶胞参数为a nm,则该晶体的密度
_______ (列出计算式) 。
。
 ),其合成原料为
),其合成原料为 、孔雀石[
、孔雀石[ ]和砂子(
]和砂子( )。回答下列问题:
)。回答下列问题:(1)基态Ba原子的价电子排布式为
(2)
 常用作光导纤维,在生产和生活中有广泛的用途。
常用作光导纤维,在生产和生活中有广泛的用途。①
 属于
属于 晶体中,硅原子的杂化类型为
晶体中,硅原子的杂化类型为 的空间构型为
的空间构型为②1mol
 晶体中,Si-O键的数目为
晶体中,Si-O键的数目为(3)
 不溶于水,但可溶于浓氨水,反应的化学方程式为
不溶于水,但可溶于浓氨水,反应的化学方程式为
 。
。①氨水中存在的化学键有
A.极性键 B.非极性键 C.氢键 D.σ键 E.π键
②
 中配体是
中配体是(4)
 的熔点比
的熔点比 的
的(5)Cu和Ba形成的某种合金的晶胞结构如图所示,设
 为阿伏加德罗常数的值,晶胞参数为a nm,则该晶体的密度
为阿伏加德罗常数的值,晶胞参数为a nm,则该晶体的密度
 。
。
您最近一年使用:0次
名校
解题方法
9 . 元素周期表第IIIA族包括B、Al、Ga等元素,它们参与形成的化合物有重要研究和应用价值,回答下列问题:
(1)基态Ga原子的价电子排布式为________ ;Ga、As和Se的第一电离能由小到大的顺序是________ 。
(2)实验发现,氯化铝溶于非极性溶剂中或处于熔融状态、蒸气状态时,都以二聚态(A12C16)的形式存在。其球棍模型如图甲所示。

①该分子中A1原子采取________ 杂化。
②Al2Cl6与过量NaOH溶液反应生成Na[A1(OH)4],[A1(OH)4]-中存在的化学键有________ (序号)。
A.离子键 B.极性共价键 C.金属键 D.非极性共价键 E.配位键 F.σ键 G.氢键
(3)更高温度下Al2Cl6二聚体离解成A1Cl3,BF3是AlCl3的一种等电子体,根据价层电子对互斥理论判断BF3的分子构型为________ ;写出BF3的一种带负电荷的等电子体粒子:________ 。
(4)GaN是第三代半导体材料的研究热点,在干燥的NH3气流中焙烧磨细的GaAs可制得GaN。GaN熔点约为1500℃,GaAs熔点为1238℃,GaN熔点高于GaAs的原因是________ 。
(5)GaN的其中一种晶胞结构如图乙所示,与金刚石的晶体结构高度相似。该晶胞中Ga原子处于N原子形成的________ (填“正四面体形”或“正八面体形”)空隙。已知GaN的密度为ρg•cm-3,Ga和N的摩尔质量分别为ag•moL-1和bg•moL-1,NA为阿伏加德罗常数,则GaN晶胞的边长为________ pm(列出表达式)。

(1)基态Ga原子的价电子排布式为
(2)实验发现,氯化铝溶于非极性溶剂中或处于熔融状态、蒸气状态时,都以二聚态(A12C16)的形式存在。其球棍模型如图甲所示。

①该分子中A1原子采取
②Al2Cl6与过量NaOH溶液反应生成Na[A1(OH)4],[A1(OH)4]-中存在的化学键有
A.离子键 B.极性共价键 C.金属键 D.非极性共价键 E.配位键 F.σ键 G.氢键
(3)更高温度下Al2Cl6二聚体离解成A1Cl3,BF3是AlCl3的一种等电子体,根据价层电子对互斥理论判断BF3的分子构型为
(4)GaN是第三代半导体材料的研究热点,在干燥的NH3气流中焙烧磨细的GaAs可制得GaN。GaN熔点约为1500℃,GaAs熔点为1238℃,GaN熔点高于GaAs的原因是
(5)GaN的其中一种晶胞结构如图乙所示,与金刚石的晶体结构高度相似。该晶胞中Ga原子处于N原子形成的

您最近一年使用:0次
解题方法
10 . 离子液体被认为是21世纪理想的绿色溶剂,是指室温或者接近室温时呈液态,而本身由阴、阳离子构成的化合物。氯代1-丁基-3-甲基咪唑离子液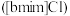 可以与
可以与 混合形成离子液体;
混合形成离子液体; 也可以转化成其他离子液体,下图是
也可以转化成其他离子液体,下图是 与
与 离子交换反应合成离子液体
离子交换反应合成离子液体 的流程:
的流程:

(1)请画出基态Ga原子的价电子排布图_____ ;同周期元素中基态原子未成对电子数与硼(B)原子相同的有_____ (填元素符号)。
(2)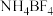 中N原子的杂化方式为
中N原子的杂化方式为_____ ,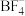 的空间构型为
的空间构型为_____ , 中几种元素电负性由大到小的顺序为
中几种元素电负性由大到小的顺序为_____ 。
(3)已知分子中的大 键可以用
键可以用 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表大
键的原子数,n代表大 键中的电子数,则
键中的电子数,则 中大
中大 键可以表示为
键可以表示为_____ 。
(4) 熔点为
熔点为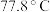 ,则
,则 的晶体类型为
的晶体类型为_____ , 和
和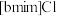 混合形成离子液体的过程中会存在以下转化:
混合形成离子液体的过程中会存在以下转化: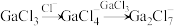 ,请画出
,请画出 的结构式
的结构式_____ 。
(5)某种 的晶胞结构如图所示,O2−以六方最密方式堆积,
的晶胞结构如图所示,O2−以六方最密方式堆积, 在其八面体空隙中(注:未全部标出,如:
在其八面体空隙中(注:未全部标出,如: 在1、2、3、4、5、6构成的八面体体心)。
在1、2、3、4、5、6构成的八面体体心)。
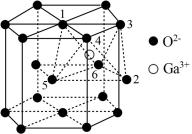
①该晶胞中O2−的配位数为_____ 。
②已知氧离子半径为acm,晶胞的高为bcm,NA代表阿伏加德罗常数的值,该晶体的密度为_____ g·cm−3(用含 和NA的代数式表示)。
和NA的代数式表示)。
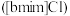 可以与
可以与 混合形成离子液体;
混合形成离子液体; 也可以转化成其他离子液体,下图是
也可以转化成其他离子液体,下图是 与
与 离子交换反应合成离子液体
离子交换反应合成离子液体 的流程:
的流程:
(1)请画出基态Ga原子的价电子排布图
(2)
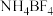 中N原子的杂化方式为
中N原子的杂化方式为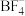 的空间构型为
的空间构型为 中几种元素电负性由大到小的顺序为
中几种元素电负性由大到小的顺序为(3)已知分子中的大
 键可以用
键可以用 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表大
键的原子数,n代表大 键中的电子数,则
键中的电子数,则 中大
中大 键可以表示为
键可以表示为(4)
 熔点为
熔点为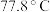 ,则
,则 的晶体类型为
的晶体类型为 和
和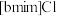 混合形成离子液体的过程中会存在以下转化:
混合形成离子液体的过程中会存在以下转化: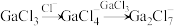 ,请画出
,请画出 的结构式
的结构式(5)某种
 的晶胞结构如图所示,O2−以六方最密方式堆积,
的晶胞结构如图所示,O2−以六方最密方式堆积, 在其八面体空隙中(注:未全部标出,如:
在其八面体空隙中(注:未全部标出,如: 在1、2、3、4、5、6构成的八面体体心)。
在1、2、3、4、5、6构成的八面体体心)。
①该晶胞中O2−的配位数为
②已知氧离子半径为acm,晶胞的高为bcm,NA代表阿伏加德罗常数的值,该晶体的密度为
 和NA的代数式表示)。
和NA的代数式表示)。
您最近一年使用:0次



