解题方法
1 . [Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2-+4H++4H2O=[Zn(H2O)4]2++4HOCH2CN
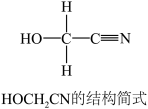
(1)Zn2+基态核外电子排布式为__________________________ 。
(2)1mol HCHO分子中含有σ键的数目为__________ mol 。
(3)HOCH2CN分子中碳原子轨道的杂化类型是________________ 。
(4)与阴离子NH 互为等电子体的分子为
互为等电子体的分子为__________________ 。
(5)尿素晶体的晶胞结构如图所示,该晶胞中有___________ 个尿素分子。


(1)Zn2+基态核外电子排布式为
(2)1mol HCHO分子中含有σ键的数目为
(3)HOCH2CN分子中碳原子轨道的杂化类型是
(4)与阴离子NH
 互为等电子体的分子为
互为等电子体的分子为(5)尿素晶体的晶胞结构如图所示,该晶胞中有

您最近一年使用:0次
解题方法
2 . 金刚砂( )是重要的工业制品,可由二氧化硅与碳的反应制得:
)是重要的工业制品,可由二氧化硅与碳的反应制得: 。
。 的晶体结构与金刚石的相似,如本章如图所示,其中C原子和
的晶体结构与金刚石的相似,如本章如图所示,其中C原子和 原子的位置是交替的。
原子的位置是交替的。

(1)X是______ ?
(2)写出基态 原子的电子排布式
原子的电子排布式______ ; 中
中 的化合价是
的化合价是______ ?
(3)X可与氧气反应生成Y,判断Y分子的中心原子杂化轨道类型和键角______
(4) 晶体与晶体硅相比,熔点较高的是
晶体与晶体硅相比,熔点较高的是______ 晶体?请分析原因______
(5)在 中最小的环上有
中最小的环上有______ 个原子,已知 键的键能为a
键的键能为a ,理论上分解1
,理论上分解1
 形成气态原子所需要的能量是
形成气态原子所需要的能量是______ 。
 )是重要的工业制品,可由二氧化硅与碳的反应制得:
)是重要的工业制品,可由二氧化硅与碳的反应制得: 。
。 的晶体结构与金刚石的相似,如本章如图所示,其中C原子和
的晶体结构与金刚石的相似,如本章如图所示,其中C原子和 原子的位置是交替的。
原子的位置是交替的。
(1)X是
(2)写出基态
 原子的电子排布式
原子的电子排布式 中
中 的化合价是
的化合价是(3)X可与氧气反应生成Y,判断Y分子的中心原子杂化轨道类型和键角
(4)
 晶体与晶体硅相比,熔点较高的是
晶体与晶体硅相比,熔点较高的是(5)在
 中最小的环上有
中最小的环上有 键的键能为a
键的键能为a ,理论上分解1
,理论上分解1
 形成气态原子所需要的能量是
形成气态原子所需要的能量是
您最近一年使用:0次
解题方法
3 . Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。回答下列问题:
(1)Ca小于Ti的是_______ ,Ti原子的核外电子排布式是_______ 。
A.最外层电子数 B.未成对电子数 C.原子半径 D.第三电离能
(2)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
①Cl2O2的沸点比H2O2低,原因是_______ ;
②O3分子中心原子杂化类型为_______ ;O3是极性分子,理由是_______ 。
(3)Na3OCl晶体属于立方晶系,其晶胞结构如图所示。已知:晶胞边长为a nm,密度为d g·cm-3。
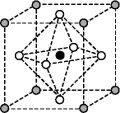
①Na3OCl晶胞中,Cl位于各顶点位置,Na位于_______ 位置,两个Na之间的最短距离为_______ nm。
②用a、d表示阿伏加德罗常数的值NA=_______ (列计算式)。
(1)Ca小于Ti的是
A.最外层电子数 B.未成对电子数 C.原子半径 D.第三电离能
(2)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
①Cl2O2的沸点比H2O2低,原因是
②O3分子中心原子杂化类型为
(3)Na3OCl晶体属于立方晶系,其晶胞结构如图所示。已知:晶胞边长为a nm,密度为d g·cm-3。

①Na3OCl晶胞中,Cl位于各顶点位置,Na位于
②用a、d表示阿伏加德罗常数的值NA=
您最近一年使用:0次
名校
解题方法
4 . 过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(1)Cr 是第___________ 周期第___________ 族元素。
(2)基态 Cr 原子的核外电子有___________ 种空间运动状态,有___________ 个未成对电子。
(3)Cr3+能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中,中心离子的配位数为___________ 。
(4)[Cr(NH3)3(H2O)2Cl]2+的配体分子 NH3 中 N 的杂化轨道类型是___________ ,H2O 的键角小于 NH3,原因是___________ 。
(5)在金属材料中添加 AlCr2 颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2 具有体心四方结构,如下图所示,处于顶角位置的是___________ 原子。若 NA 表示阿伏加德罗常数的值,则该晶体的密度为___________ g∙cm−3(用含 a、c 和 NA 的代数式表示)。晶胞中长、宽为a nm,高为c nm。
(1)Cr 是第
(2)基态 Cr 原子的核外电子有
(3)Cr3+能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中,中心离子的配位数为
(4)[Cr(NH3)3(H2O)2Cl]2+的配体分子 NH3 中 N 的杂化轨道类型是
(5)在金属材料中添加 AlCr2 颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2 具有体心四方结构,如下图所示,处于顶角位置的是

您最近一年使用:0次
2022-01-07更新
|
350次组卷
|
3卷引用:天津市南开区2021-2022学年高三上学期期末考试化学试卷
名校
5 . 全固态激光器所用的磷酸钛氧钾、氟硼铍酸钾是一种非线性光学晶体,我国是率先掌握通过非线性光学晶体变频来获得深紫外激光技术的国家,回答下列问题。
(1)写出Ti基态原子的价电子排布式___________ , 电子占据的轨道数为
电子占据的轨道数为___________ 个。
(2)Be和B的第一电离能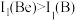 的原因是
的原因是___________ 。
(3) 在水溶液中存在解离反应:H
在水溶液中存在解离反应:H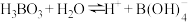 ,
, 中存在配位键,其中B原子的杂化类型是
中存在配位键,其中B原子的杂化类型是___________ ,从原子结构分析 中能形成配位键的原因是
中能形成配位键的原因是___________ 。
(4)氟硼酸钾是制备氟硼铍酸钾的原料之一,氟硼酸钾在高温下分解为KF和 ,二者的沸点分别为1500℃、-101℃。KF的沸点远高于
,二者的沸点分别为1500℃、-101℃。KF的沸点远高于 的原因是
的原因是___________ 。
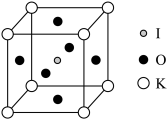
(5) 晶体也是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长为
晶体也是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长为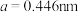 ,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为
,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为___________ (保留三位有效数字)nm,与K紧邻的O个数为___________ 。
(1)写出Ti基态原子的价电子排布式
 电子占据的轨道数为
电子占据的轨道数为(2)Be和B的第一电离能
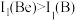 的原因是
的原因是(3)
 在水溶液中存在解离反应:H
在水溶液中存在解离反应:H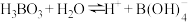 ,
, 中存在配位键,其中B原子的杂化类型是
中存在配位键,其中B原子的杂化类型是 中能形成配位键的原因是
中能形成配位键的原因是(4)氟硼酸钾是制备氟硼铍酸钾的原料之一,氟硼酸钾在高温下分解为KF和
 ,二者的沸点分别为1500℃、-101℃。KF的沸点远高于
,二者的沸点分别为1500℃、-101℃。KF的沸点远高于 的原因是
的原因是(5)
 晶体也是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长为
晶体也是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长为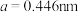 ,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为
,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为
您最近一年使用:0次
名校
解题方法
6 . 稀土元素是指元素周期表中原子序数为57到71的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17种元素.回答下列问题;
(1)钪(Sc)元素的原子核外电子排布式为_____________ 。钬(Ho)的基态原子电子排布式为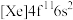 ,一个基态原子所含的未成对电子数为
,一个基态原子所含的未成对电子数为_________ 。
(2)稀土元素最常见的化合价为+3价,但也有少数还有+4价。请根据下表中的电离能数据判断表中最有可能有+4价的元素是_____________ 。
几种稀土元素的电离能(单位:kJ/mol)
(3)Sm(钐)的单质与1,2-二碘乙烷可发生如下反应:Sm +ICH2CH2I→SmI2+ CH2=CH2;ICH2CH2I中碳原子杂化轨道类型为________ 。
(4)离子化合物Na3[Sc(OH)6]中,存在的作用力除离子键外还有___________ 。
(5)1molCH2=CH2中含有的 键数目为:
键数目为:____________ 。
(1)钪(Sc)元素的原子核外电子排布式为
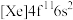 ,一个基态原子所含的未成对电子数为
,一个基态原子所含的未成对电子数为(2)稀土元素最常见的化合价为+3价,但也有少数还有+4价。请根据下表中的电离能数据判断表中最有可能有+4价的元素是
几种稀土元素的电离能(单位:kJ/mol)
| 元素 | I1 | I2 | I3 | I1+I2+I3 | I4 |
| Sc(钪) | 633 | 1235 | 2389 | 4257 | 7019 |
| Y(钇) | 616 | 1181 | 1980 | 3777 | 5963 |
| La(镧) | 538 | 1067 | 1850 | 3455 | 4819 |
| Ce(铈) | 527 | 1047 | 1949 | 3523 | 3547 |
(4)离子化合物Na3[Sc(OH)6]中,存在的作用力除离子键外还有
(5)1molCH2=CH2中含有的
 键数目为:
键数目为:
您最近一年使用:0次
解题方法
7 . 铝镍钴系永磁合金以铁,镍、铝元素为主要成分,还含有铜、钴、钛等元素.具有高剩磁和低温度系数,磁性稳定.现多用于仪表工业中制造磁电系仪表、流量计、微特电机,继电器等。
(1)铁、钴、镍元素性质非常相似,原子半径接近但依次减小,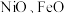 的晶体结构类型与氯化钠相同.基态钴原子价电子轨道表示式为
的晶体结构类型与氯化钠相同.基态钴原子价电子轨道表示式为________ ,熔沸点:
____  (填“<”“>”或“=”)。
(填“<”“>”或“=”)。
(2) 俗称摩尔盐,相对于
俗称摩尔盐,相对于 而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制
而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制 (Ⅱ)的标准溶液,硫酸亚铁铵晶体中亚铁离子稳定存在的原因是
(Ⅱ)的标准溶液,硫酸亚铁铵晶体中亚铁离子稳定存在的原因是___________ 。
(3)氢能源发展的关键环节是新型储氢材料,氨硼烷 常温下以固体稳定存在,极易溶于水,是一种理想的新型储氢材料。
常温下以固体稳定存在,极易溶于水,是一种理想的新型储氢材料。
①氨硼烷分子中B原子采取_________ 杂化。
②氨硼烷晶体中存在的作用力有范德华力,极性键、________ 和________ 。
(4)立方氮化硼 晶体的晶胞结构如图1所示,N原子为面心立方最密堆积。
晶体的晶胞结构如图1所示,N原子为面心立方最密堆积。
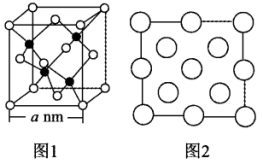
图2是立方氮化硼晶胞的俯视投影图.请在图中用“●”标明B原子的相对位置________ 。
(1)铁、钴、镍元素性质非常相似,原子半径接近但依次减小,
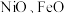 的晶体结构类型与氯化钠相同.基态钴原子价电子轨道表示式为
的晶体结构类型与氯化钠相同.基态钴原子价电子轨道表示式为
 (填“<”“>”或“=”)。
(填“<”“>”或“=”)。(2)
 俗称摩尔盐,相对于
俗称摩尔盐,相对于 而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制
而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制 (Ⅱ)的标准溶液,硫酸亚铁铵晶体中亚铁离子稳定存在的原因是
(Ⅱ)的标准溶液,硫酸亚铁铵晶体中亚铁离子稳定存在的原因是(3)氢能源发展的关键环节是新型储氢材料,氨硼烷
 常温下以固体稳定存在,极易溶于水,是一种理想的新型储氢材料。
常温下以固体稳定存在,极易溶于水,是一种理想的新型储氢材料。①氨硼烷分子中B原子采取
②氨硼烷晶体中存在的作用力有范德华力,极性键、
(4)立方氮化硼
 晶体的晶胞结构如图1所示,N原子为面心立方最密堆积。
晶体的晶胞结构如图1所示,N原子为面心立方最密堆积。
图2是立方氮化硼晶胞的俯视投影图.请在图中用“●”标明B原子的相对位置
您最近一年使用:0次
名校
解题方法
8 . VIA族的氧、硫、硒Se、碲Te等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
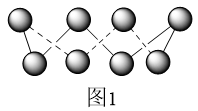
(1)S单质的常见形式是S8,其环状结构如图1所示,S原子采用的轨道杂化方式是____________ ;
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为_________ ;
(3)Se的原子序数为________ ,其核外价电子的排布式为_______ ;
(4)H2Se的酸性比H2S_____________ (填“强”或“弱”),气态SeO3分子的立体构型为_____________ , 离子的立体构型为
离子的立体构型为_____________ ;
(5)H2SeO4与H2SeO3酸性强弱比较:H2SeO4的酸性比H2SeO3_____ (填“强”或“弱”)。
(6)O的非金属性比S____ (填“强”或“弱”),例举一个化学方程式说明:_____ 。
(1)S单质的常见形式是S8,其环状结构如图1所示,S原子采用的轨道杂化方式是

(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为
(3)Se的原子序数为
(4)H2Se的酸性比H2S
 离子的立体构型为
离子的立体构型为(5)H2SeO4与H2SeO3酸性强弱比较:H2SeO4的酸性比H2SeO3
(6)O的非金属性比S
您最近一年使用:0次
名校
解题方法
9 . NH3在工农业生产中具有重要的作用,可以用来生产尿素等化学肥料,也可以用来制备一些配位化合物。
(1)合成氨是人类科学技术上的一项重大突破,工业合成氨生产中常用铁触媒作催化剂.请写出Fe元素的基态原子的电子排布式:_____________________ 。
(2) ,则CO(NH2)2分子中
,则CO(NH2)2分子中 原子的杂化方式为
原子的杂化方式为___________ 。其中C、N、O三种元素的第一电离能由小到大的顺序为____________________ 。
1mol CO(NH2)2中含有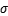 键的数目为
键的数目为____________ 。
(3)向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的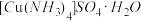 晶体,与该物质中的配体互为等电子体的阴离子的化学式为
晶体,与该物质中的配体互为等电子体的阴离子的化学式为________ 。
(4)写出将过量氨水缓慢滴入硫酸铜溶液中发生反应的离子方程式:__________ 、__________
(1)合成氨是人类科学技术上的一项重大突破,工业合成氨生产中常用铁触媒作催化剂.请写出Fe元素的基态原子的电子排布式:
(2)
 ,则CO(NH2)2分子中
,则CO(NH2)2分子中 原子的杂化方式为
原子的杂化方式为1mol CO(NH2)2中含有
 键的数目为
键的数目为(3)向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的
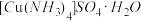 晶体,与该物质中的配体互为等电子体的阴离子的化学式为
晶体,与该物质中的配体互为等电子体的阴离子的化学式为(4)写出将过量氨水缓慢滴入硫酸铜溶液中发生反应的离子方程式:
您最近一年使用:0次
解题方法
10 . ⅢA、VA族元素组成的化合物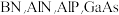 是人工合成的具有特殊功能的新材料,回答下列问题:
是人工合成的具有特殊功能的新材料,回答下列问题:
(1)基态B原子的电子排布式为___________ ;BN中B元素的化合价为___________ 。
(2)As基态原子的电子占据了___________ 个能层,最高能级的电子排布式为___________ ;和As位于同一周期,且未成对电子数也相同的元素还有___________ 种。
(3)元素周期表中与P紧邻的4种元素中电负性最大的是___________ (填元素符号):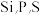 三种元素的第一电离能由大到小的顺序是
三种元素的第一电离能由大到小的顺序是___________ 。
(4)已知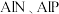 等半导体材料的晶体结构与单晶硅相似,则
等半导体材料的晶体结构与单晶硅相似,则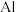 原子的杂化形式为
原子的杂化形式为___________ ;晶体结构中存在的化学键有___________ (填字母代号)。
A.离子键 B.σ键 C.π键 D.配位键
(5)立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为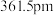 ,立方氮化硼的密度是
,立方氮化硼的密度是___________  (只要求列算式,不必计算出数值,阿伏加德罗常数为
(只要求列算式,不必计算出数值,阿伏加德罗常数为 )。
)。
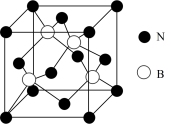
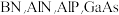 是人工合成的具有特殊功能的新材料,回答下列问题:
是人工合成的具有特殊功能的新材料,回答下列问题:(1)基态B原子的电子排布式为
(2)As基态原子的电子占据了
(3)元素周期表中与P紧邻的4种元素中电负性最大的是
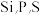 三种元素的第一电离能由大到小的顺序是
三种元素的第一电离能由大到小的顺序是(4)已知
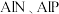 等半导体材料的晶体结构与单晶硅相似,则
等半导体材料的晶体结构与单晶硅相似,则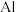 原子的杂化形式为
原子的杂化形式为A.离子键 B.σ键 C.π键 D.配位键
(5)立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为
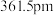 ,立方氮化硼的密度是
,立方氮化硼的密度是 (只要求列算式,不必计算出数值,阿伏加德罗常数为
(只要求列算式,不必计算出数值,阿伏加德罗常数为 )。
)。
您最近一年使用:0次



