1 . Ⅰ.完成下列选择题
(1)对于钠的卤化物(NaX)和硅的卤化物(SiX4)下列叙述正确的是________
Ⅱ.碳元素单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
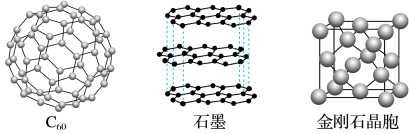
回答下列问题:
(2)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为_______ 。
(3)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为_______ 、_______ 。
(4)C60属于_______ 晶体,石墨属于_______ 晶体。
(5)石墨晶体中,层内C-C键的键长为142 pm,而金刚石中C-C键的键长为154 pm,其原因是金刚石中只存在C-C间_______ 共价键(σ或π),而石墨层内的C-C间不仅存在_______ 共价键(σ或π),还有_______ 键(σ或π)。
(6)金刚石晶胞含有_______ 个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=_______ a,列式表示碳原子在晶胞中的空间占有率_______ (不要求计算结果)。
(1)对于钠的卤化物(NaX)和硅的卤化物(SiX4)下列叙述正确的是________
| A.SiX4是离子晶体 | B.SiX4是共价化合物 |
| C.NaX不溶于水 | D.NaX的熔点一般高于SiX4 |
Ⅱ.碳元素单质有多种形式,下图依次是C60、石墨和金刚石的结构图:

回答下列问题:
(2)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为
(3)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为
(4)C60属于
(5)石墨晶体中,层内C-C键的键长为142 pm,而金刚石中C-C键的键长为154 pm,其原因是金刚石中只存在C-C间
(6)金刚石晶胞含有
您最近一年使用:0次
2 . 工业上常用尿素[CO(NH2)2]和NaClO溶液反应制备水合肼。水合肼(N2H4·H2O)可用作抗氧剂等。
已知:I.N2H4·H2O的结构如图(…表示氢键)。

II.N2H4·H2O沸点118℃,具有强还原性。
(1)将Cl2通入过量NaOH溶液中制备NaClO,得到溶液X,离子方程式是_______ 。
(2)制备水合肼:将溶液X滴入尿素水溶液中,控制一定温度,装置如下图(夹持及控温装置已略)。充分反应后,A中的溶液经蒸馏获得水合肼粗品后,剩余溶液再进一步处理还可获得副产品NaCl和Na2CO3·10H2O。

①A中反应的化学方程式是_______ 。
②冷凝管的作用是_______ 。
③若滴加NaClO溶液的速度较快时,水合肼的产率会下降,原因是_______ 。
(3)水合肼在溶液中可发生类似NH3·H2O的电离,呈弱碱性;其分子中与N原子相连的H原子易发生取代反应。
①水合肼和盐酸按物质的量之比1∶1反应的离子方程式是_______ 。
②碳酰肼(CH6N4O)是目前去除锅炉水中氧气的最先进材料,由水合肼与DEC( )发生取代反应制得。碳酰肼的结构简式是
)发生取代反应制得。碳酰肼的结构简式是_______ 。
(4)尿素还可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(III),化学式为[Fe(H2NCONH2)6](NO3)3。
①C、N、O三种元素的第一电离能由大到小的顺序是_______ 。
②尿素分子中C和N原子的杂化方式分别是_______ 、_______ 。
③[Fe(H2NCONH2)6](NO3)3中H2NCONH2与Fe(III)之间的作用力是_______ 。
④FeCl3溶液与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是_______ 。
已知:I.N2H4·H2O的结构如图(…表示氢键)。

II.N2H4·H2O沸点118℃,具有强还原性。
(1)将Cl2通入过量NaOH溶液中制备NaClO,得到溶液X,离子方程式是
(2)制备水合肼:将溶液X滴入尿素水溶液中,控制一定温度,装置如下图(夹持及控温装置已略)。充分反应后,A中的溶液经蒸馏获得水合肼粗品后,剩余溶液再进一步处理还可获得副产品NaCl和Na2CO3·10H2O。

①A中反应的化学方程式是
②冷凝管的作用是
③若滴加NaClO溶液的速度较快时,水合肼的产率会下降,原因是
(3)水合肼在溶液中可发生类似NH3·H2O的电离,呈弱碱性;其分子中与N原子相连的H原子易发生取代反应。
①水合肼和盐酸按物质的量之比1∶1反应的离子方程式是
②碳酰肼(CH6N4O)是目前去除锅炉水中氧气的最先进材料,由水合肼与DEC(
 )发生取代反应制得。碳酰肼的结构简式是
)发生取代反应制得。碳酰肼的结构简式是(4)尿素还可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(III),化学式为[Fe(H2NCONH2)6](NO3)3。
①C、N、O三种元素的第一电离能由大到小的顺序是
②尿素分子中C和N原子的杂化方式分别是
③[Fe(H2NCONH2)6](NO3)3中H2NCONH2与Fe(III)之间的作用力是
④FeCl3溶液与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是
您最近一年使用:0次
3 . 元素X、Y、Z为前四周期元素,X的基态原子核外电子有21种运动状态,元素Y的原子最外层电子数是其内层的3倍,Z与X、Y不在同一周期,且Z原子核外p电子比s电子多5个。
(1)X基态原子的核外电子排布式为_______ ,Y的原子结构示意图_______ 。
(2)X是石油化工中重要的催化剂之一,如催化异丙苯( )裂化生成苯和丙烯。
)裂化生成苯和丙烯。
① 1 mol苯分子中含有σ 键的数目为_______ mol。
② 异丙苯分子中碳原子轨道的杂化类型为_______ 。
(3)Y的氢化物沸点高于同族氢化物沸点的原因_______ 。
(4)XZ3易溶于水,熔点为960 ℃,熔融状态下能够导电,据此可判断XY3晶体属于_______ (填晶体类型)。
(5)元素Ce与X同族,其与Y形成的化合物晶体的晶胞结构如下图,该化合物的化学式为_______ 。
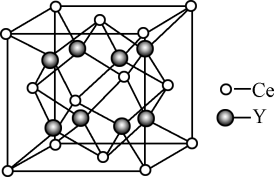
(1)X基态原子的核外电子排布式为
(2)X是石油化工中重要的催化剂之一,如催化异丙苯(
 )裂化生成苯和丙烯。
)裂化生成苯和丙烯。① 1 mol苯分子中含有σ 键的数目为
② 异丙苯分子中碳原子轨道的杂化类型为
(3)Y的氢化物沸点高于同族氢化物沸点的原因
(4)XZ3易溶于水,熔点为960 ℃,熔融状态下能够导电,据此可判断XY3晶体属于
(5)元素Ce与X同族,其与Y形成的化合物晶体的晶胞结构如下图,该化合物的化学式为

您最近一年使用:0次
解题方法
4 . 研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_______ 。元素Mn与O中,第一电离能较大的是_______ ,基态原子核外未成对电子数较多的是_______ 。
(2)CO2和CH3OH分子中C原子的杂化形式分别为_______ 和_______ 。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_______
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在_______ 。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为_______ nm。MnO也属于NaCl型结构,晶胞参数为a′=0.448 nm,则r(Mn2+)为_______ nm。
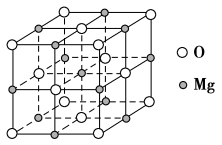
(1)Co基态原子核外电子排布式为
(2)CO2和CH3OH分子中C原子的杂化形式分别为
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为

您最近一年使用:0次
解题方法
5 . 元素周期表在化学中有举足轻重的地位。请根据提示回答下列问题:
(1)铁在生活生产中用途广泛,写出 Fe 在元素周期表中的位置_______ 。Fe 分别与硫单质和氯气共热,可以得到两种含铁的二元化合物。请问这两种物质中金属阳离子的未成对电子数之比为_______ 。
(2)古往今来,人类发展的脚步离不开青铜器的冶炼,锻造及使用。如今,铜元素依旧为科研人员所钟爱,请写出铜原子的价电子排布式_______ 。利用铜离子作为中心原子可以形成多种具有良好特性的配合物。我们熟知的是一种深蓝色配合物,向硫酸铜溶液中通入过量氨气,可制备这种深蓝色配合物[Cu(NH3)4]2+。请用适当的化学用语描述该反应过程的实质_______ 。写出[Cu(NH3)4]2+配体的电子式_______ 。
(3)I1表示第一电离,I1(Mg)> I1(Al)> I1(Na),原因是_______ 。
(4)CoO 的晶胞如图所示。
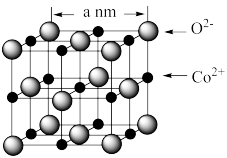
设阿伏加德罗常数的值为 NA,则 CoO 晶体的密度为_______ g﹒cm−3(列出计算式即可)
(5)磷元素在农药的合成中有着重要作用。了解其化合物的结构有助于我们合成新型农药,提高粮食的产量。PO 的 VSEPR 模型为
的 VSEPR 模型为_______ ,其中 P 的杂化轨道类型为_______ 。
(6)配位化学中,硼元素深受研究者的喜爱。其原因在于 B 容易与配体形成配位键,如BF 、B(OH)
、B(OH) 等,从原子结构分析其原因
等,从原子结构分析其原因_______ 。
(7)溶解度、熔沸点、颜色等是每种物质自身特有的性质,但也存在一定的规律。
①水和 H2S 均可以溶于乙醇,但 H2O 在乙醇中的溶解度大于 H2S 的原因_______
a.水和乙醇均为分子晶体 b.水和乙醇分子间可以形成氢键 c.水和乙醇可以发生反应
②比较下列锗卤化物的熔点和沸点,分析其变化规律的原因_______ 。
(1)铁在生活生产中用途广泛,写出 Fe 在元素周期表中的位置
(2)古往今来,人类发展的脚步离不开青铜器的冶炼,锻造及使用。如今,铜元素依旧为科研人员所钟爱,请写出铜原子的价电子排布式
(3)I1表示第一电离,I1(Mg)> I1(Al)> I1(Na),原因是
(4)CoO 的晶胞如图所示。

设阿伏加德罗常数的值为 NA,则 CoO 晶体的密度为
(5)磷元素在农药的合成中有着重要作用。了解其化合物的结构有助于我们合成新型农药,提高粮食的产量。PO
 的 VSEPR 模型为
的 VSEPR 模型为(6)配位化学中,硼元素深受研究者的喜爱。其原因在于 B 容易与配体形成配位键,如BF
 、B(OH)
、B(OH) 等,从原子结构分析其原因
等,从原子结构分析其原因(7)溶解度、熔沸点、颜色等是每种物质自身特有的性质,但也存在一定的规律。
①水和 H2S 均可以溶于乙醇,但 H2O 在乙醇中的溶解度大于 H2S 的原因
a.水和乙醇均为分子晶体 b.水和乙醇分子间可以形成氢键 c.水和乙醇可以发生反应
②比较下列锗卤化物的熔点和沸点,分析其变化规律的原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | −49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约 400 |
您最近一年使用:0次
解题方法
6 . 金刚砂( )是重要的工业制品,可由二氧化硅与碳的反应制得:
)是重要的工业制品,可由二氧化硅与碳的反应制得: 。
。 的晶体结构与金刚石的相似,如本章如图所示,其中C原子和
的晶体结构与金刚石的相似,如本章如图所示,其中C原子和 原子的位置是交替的。
原子的位置是交替的。

(1)X是______ ?
(2)写出基态 原子的电子排布式
原子的电子排布式______ ; 中
中 的化合价是
的化合价是______ ?
(3)X可与氧气反应生成Y,判断Y分子的中心原子杂化轨道类型和键角______
(4) 晶体与晶体硅相比,熔点较高的是
晶体与晶体硅相比,熔点较高的是______ 晶体?请分析原因______
(5)在 中最小的环上有
中最小的环上有______ 个原子,已知 键的键能为a
键的键能为a ,理论上分解1
,理论上分解1
 形成气态原子所需要的能量是
形成气态原子所需要的能量是______ 。
 )是重要的工业制品,可由二氧化硅与碳的反应制得:
)是重要的工业制品,可由二氧化硅与碳的反应制得: 。
。 的晶体结构与金刚石的相似,如本章如图所示,其中C原子和
的晶体结构与金刚石的相似,如本章如图所示,其中C原子和 原子的位置是交替的。
原子的位置是交替的。
(1)X是
(2)写出基态
 原子的电子排布式
原子的电子排布式 中
中 的化合价是
的化合价是(3)X可与氧气反应生成Y,判断Y分子的中心原子杂化轨道类型和键角
(4)
 晶体与晶体硅相比,熔点较高的是
晶体与晶体硅相比,熔点较高的是(5)在
 中最小的环上有
中最小的环上有 键的键能为a
键的键能为a ,理论上分解1
,理论上分解1
 形成气态原子所需要的能量是
形成气态原子所需要的能量是
您最近一年使用:0次
名校
解题方法
7 . 中国科学家合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料 ,并获得该化合物的
,并获得该化合物的 器件,该结果有望为白光发射的设计和应用提供新的有效策略。
器件,该结果有望为白光发射的设计和应用提供新的有效策略。
(1)已知 与
与 同族,基态
同族,基态 原子价层电子的运动状态有
原子价层电子的运动状态有_________ 种,基态 原子的电子排布式不能表示为
原子的电子排布式不能表示为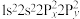 ,因为这违背了
,因为这违背了_________ (填选项)。
A.能量最低原理 B.泡利不相容原理 C.洪特规则
(2) 中硼原子的杂化轨道类型为
中硼原子的杂化轨道类型为_________ 。 中,
中, 与
与 之间不存在的化学键是
之间不存在的化学键是_________ (填选项)。
A. 键 B.
键 B.  键 C. 配位键 D. 极性键
键 C. 配位键 D. 极性键
(3)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较低的是_________ ,其原因是__________________ 。
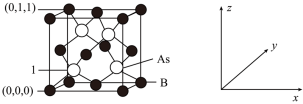
(4)超高热导率半导体材料砷化硼( )的晶胞结构如图所示,则1号砷原子的原子坐标为
)的晶胞结构如图所示,则1号砷原子的原子坐标为_________ 。已知阿伏加德罗常数的值为 ,若晶胞中
,若晶胞中 原子到
原子到 原子最近距离为
原子最近距离为 ,则该晶体的密度为
,则该晶体的密度为_________  (列出含
(列出含 、
、 的计算式即可)。
的计算式即可)。
 ,并获得该化合物的
,并获得该化合物的 器件,该结果有望为白光发射的设计和应用提供新的有效策略。
器件,该结果有望为白光发射的设计和应用提供新的有效策略。(1)已知
 与
与 同族,基态
同族,基态 原子价层电子的运动状态有
原子价层电子的运动状态有 原子的电子排布式不能表示为
原子的电子排布式不能表示为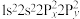 ,因为这违背了
,因为这违背了A.能量最低原理 B.泡利不相容原理 C.洪特规则
(2)
 中硼原子的杂化轨道类型为
中硼原子的杂化轨道类型为 中,
中, 与
与 之间不存在的化学键是
之间不存在的化学键是A.
 键 B.
键 B.  键 C. 配位键 D. 极性键
键 C. 配位键 D. 极性键(3)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较低的是
(4)超高热导率半导体材料砷化硼(
 )的晶胞结构如图所示,则1号砷原子的原子坐标为
)的晶胞结构如图所示,则1号砷原子的原子坐标为 ,若晶胞中
,若晶胞中 原子到
原子到 原子最近距离为
原子最近距离为 ,则该晶体的密度为
,则该晶体的密度为 (列出含
(列出含 、
、 的计算式即可)。
的计算式即可)。
您最近一年使用:0次
2022-11-13更新
|
434次组卷
|
6卷引用:山西省太原市第五中学2021-2022学年上学期高三第四次模块诊断化学试题
山西省太原市第五中学2021-2022学年上学期高三第四次模块诊断化学试题(已下线)第十一单元 物质结构与性质(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)一轮巩固卷7-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)广东省广州市广大附中、广外、铁一中学三校2022届高三三模联考化学试题福建永春一中、培元中学、季延中学、石光中学2022-2023学年高三上学期期中考联考化学试题(已下线)化学(全国乙卷单科卷)-学易金卷:2023年高考第一次模拟考试卷
解题方法
8 . 回答下列问题:
(1)若BCl3与XYn通过B原子与X原子间的配位键结合形成配合物,则该配合物提供孤电子对的原子是___________ 。
(2)NH3与BF3可以通过配位键形成NH3·BF3___________ 原子提供孤电子对,___________ 原子提供空轨道。写出NH3·BF3的结构式,并用“→”表示出配位键___________ 。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内存在___________ (填序号)。
a.离子键 b.配位键 c.共价键
(4)向盛有硫酸铜溶液的试管中滴加氨水,先生成难溶物,继续滴加氨水,难溶物溶解,得到深蓝色透明溶液。下列对此现象的说法正确的是___________。
(5)向氯化铜溶液中加入过量浓氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]Cl2晶体,深蓝色晶体中含有的化学键除普通的共价键外,还有___________ 和___________ 。
(1)若BCl3与XYn通过B原子与X原子间的配位键结合形成配合物,则该配合物提供孤电子对的原子是
(2)NH3与BF3可以通过配位键形成NH3·BF3
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内存在
a.离子键 b.配位键 c.共价键
(4)向盛有硫酸铜溶液的试管中滴加氨水,先生成难溶物,继续滴加氨水,难溶物溶解,得到深蓝色透明溶液。下列对此现象的说法正确的是___________。
| A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
| B.沉淀溶解后,生成深蓝色的配离子[Cu(NH3)4]2+ |
| C.[Cu(NH3)4]2+的立体构型为正四面体形 |
| D.在[Cu(NH3)4]2+配离子中,Cu2+给出孤电子对,NH3提供空轨道 |
您最近一年使用:0次
9 . 铂是贵金属之一,俗称白金,其单质和化合物均有重要的应用。
(1)顺铂即顺式一二氯二氨合铂(Ⅱ),反铂即反式一二氯二氨合铂(Ⅱ),结构如图所示。
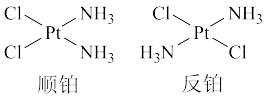
①顺铂是抗癌药物,反铂不仅不能治疗癌症,还有较强毒性,二者的关系是_______ (填标号,下同)。
A.同种物质 B.互为同素异形体 C.互为同分异构体 D.互为同位素
② 与
与 能形成配位键的原因是
能形成配位键的原因是_______ 。
③由以上事实可判断中心原子 杂化方式肯定不是
杂化方式肯定不是 杂化,判断理由是
杂化,判断理由是_______ 。
(2)海绵铂为灰色海绵状物质,有很大的比表面积,对气体(特别是氢气、氧气和一氧化碳)有较强的吸收能力。
①基态氧原子和基态碳原子的未成对电子数之比是_______ 。
②元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能( ),则
),则 和
和 中第一电子亲和能较大的元素是
中第一电子亲和能较大的元素是_______ 。
(3)铂可溶于王水(浓盐酸和浓硝酸按体积比为3:1组成的混合物),王水中含有亚硝酰氯( )。下列说法错误的是_______。
)。下列说法错误的是_______。
(1)顺铂即顺式一二氯二氨合铂(Ⅱ),反铂即反式一二氯二氨合铂(Ⅱ),结构如图所示。
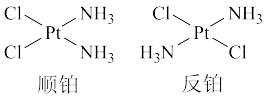
①顺铂是抗癌药物,反铂不仅不能治疗癌症,还有较强毒性,二者的关系是
A.同种物质 B.互为同素异形体 C.互为同分异构体 D.互为同位素
②
 与
与 能形成配位键的原因是
能形成配位键的原因是③由以上事实可判断中心原子
 杂化方式肯定不是
杂化方式肯定不是 杂化,判断理由是
杂化,判断理由是(2)海绵铂为灰色海绵状物质,有很大的比表面积,对气体(特别是氢气、氧气和一氧化碳)有较强的吸收能力。
①基态氧原子和基态碳原子的未成对电子数之比是
②元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(
 ),则
),则 和
和 中第一电子亲和能较大的元素是
中第一电子亲和能较大的元素是(3)铂可溶于王水(浓盐酸和浓硝酸按体积比为3:1组成的混合物),王水中含有亚硝酰氯(
 )。下列说法错误的是_______。
)。下列说法错误的是_______。A. 、 、 均为强电解质 均为强电解质 | B. 分子中 分子中 键和 键和 键的个数比为2:1 键的个数比为2:1 |
C. 为直线形分子 为直线形分子 | D. 是极性分子 是极性分子 |
您最近一年使用:0次
解题方法
10 . 铁(Fe)、钴(Co)、镍(Ni)是第四周期第VIII族的元素,在化学上称为铁系元素,其化合物在生产生活中应用广泛。
(1)基态Ni原子的核外价层电子排布图为_______ 。
(2)铁系元素能与CO形成Fe(CO)5、Ni(CO)4等金属羰基化合物。已知室温时Fe(CO)5为浅黄色液体,沸点103oC,则Fe(CO)5中含有的化学键类型包括_______。
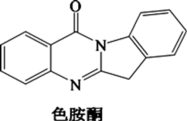
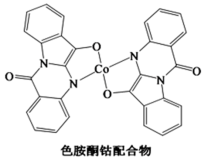
(3)以甲醇为溶剂,Co2+可与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如下所示)。色胺酮分子中所含元素(C、N、O)第一电离能由大到小的顺序为_______ ,色氨酮分子中N原子的杂化类型为_______ 。X射线衍射分析显示色胺酮钴配合物晶胞中还含有一个CH3OH分子,CH3OH是通过_______ 作用与色胺酮钴配合物相结合。

(4)LiFePO4常用作锂离子电池的正极材料,其阴离子PO 的空间构型为
的空间构型为_______ 。
(5)Fe、Co、Ni与Ca都位于第四周期且最外层电子数相同,但相应单质的熔点,Fe、Co、Ni明显高于Ca,其原因是_______ 。
(1)基态Ni原子的核外价层电子排布图为
(2)铁系元素能与CO形成Fe(CO)5、Ni(CO)4等金属羰基化合物。已知室温时Fe(CO)5为浅黄色液体,沸点103oC,则Fe(CO)5中含有的化学键类型包括_______。
| A.极性共价键 | B.离子键 | C.配位键 | D.金属键 |



(4)LiFePO4常用作锂离子电池的正极材料,其阴离子PO
 的空间构型为
的空间构型为(5)Fe、Co、Ni与Ca都位于第四周期且最外层电子数相同,但相应单质的熔点,Fe、Co、Ni明显高于Ca,其原因是
您最近一年使用:0次



