名校
1 . 沙丁胺醇有明显的支气管舒张作用,临床上主要用于治疗喘息型支气管炎、支气管哮喘等,其中一条通用的合成路线如下:
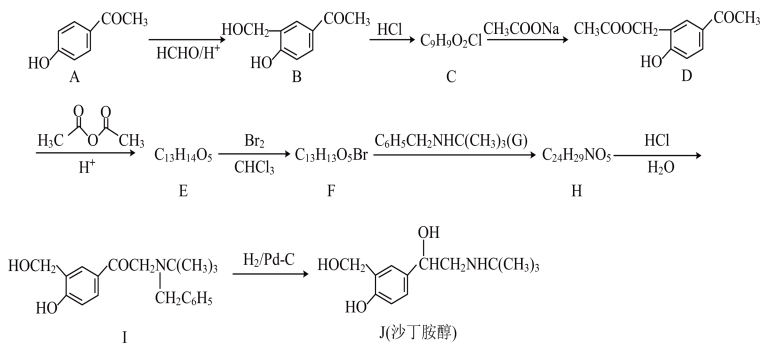
已知:(1)R-OH ROOCCH3+CH3COOH (2)R-X+
ROOCCH3+CH3COOH (2)R-X+ →
→ +HX
+HX
请回答:
(1)A中官能团名称为___________ ,A中1molA 含δ键数为___________ NA。
(2)B→C的反应类型是___________ 。G中N原子的杂化方式___________ 。
(3)F→H的化学反应方程式为___________ 。
(4)E的结构简式为___________ ,设计D→E的目的是___________ 。
(5)写出同时满足下列条件的B的同分异构体的结构简式___________ 。(不考虑立体异构,只需写出2个)
①遇FeCl3溶液显紫色;②能发生银镜反应;③分子中有4种不同化学环境的H原子

已知:(1)R-OH
 ROOCCH3+CH3COOH (2)R-X+
ROOCCH3+CH3COOH (2)R-X+ →
→ +HX
+HX请回答:
(1)A中官能团名称为
(2)B→C的反应类型是
(3)F→H的化学反应方程式为
(4)E的结构简式为
(5)写出同时满足下列条件的B的同分异构体的结构简式
①遇FeCl3溶液显紫色;②能发生银镜反应;③分子中有4种不同化学环境的H原子
您最近一年使用:0次
名校
解题方法
2 . 某催化剂材料中包含了Fe、Cr、Ni、C等多种元素。回答下列问题:
(1)基态铁原子的价电子排布式为_______ 。
(2)与Cr同周期且基态原子最外层电子数相同的元素,可能位于周期表中的_______ 区。
(3)实验室常用KSCN溶液、苯酚(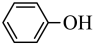 )检验Fe,其中N、O、S的第一电离能由大到小的顺序为
)检验Fe,其中N、O、S的第一电离能由大到小的顺序为_______ (用元素符号表示),苯酚中碳原子的杂化轨道类型为_______ 。
(4)铁元素能与CO形成五羰基铁[Fe(CO)5],Fe(CO)5可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含_______ molσ键,与CO互为等电子体的一种离子的化学式为_______ 。
(5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的_______ 空隙和_______ 空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0,0),B( ,0,
,0, ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为_______ 。
(6)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体中Ni2+与Ni3+的最简整数比为_______ ,晶胞参数为428pm,则晶体密度为_______ g/cm3(NA表示阿伏伽德罗常数的值,列出表达式)。

(1)基态铁原子的价电子排布式为
(2)与Cr同周期且基态原子最外层电子数相同的元素,可能位于周期表中的
(3)实验室常用KSCN溶液、苯酚(
 )检验Fe,其中N、O、S的第一电离能由大到小的顺序为
)检验Fe,其中N、O、S的第一电离能由大到小的顺序为(4)铁元素能与CO形成五羰基铁[Fe(CO)5],Fe(CO)5可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含
(5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的
 ,0,
,0, ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为(6)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体中Ni2+与Ni3+的最简整数比为

您最近一年使用:0次
名校
解题方法
3 . 很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物Ⅱ。

(1)基态硫原子价电子排布式为_______ 。
(2) 、
、 、
、 的沸点由高到低顺序为
的沸点由高到低顺序为_______ 。
(3)汞的原子序数为80,位于元素周期表第_______ 周期ⅡB族。
(4)化合物Ⅲ也是一种汞解毒剂,化合物Ⅳ是一种强酸,下列说法正确的有_______ 。
A.在Ⅰ中S原子采取 杂化
杂化
B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物Ⅰ与化合物Ⅲ相比水溶性较好的是_______ 。
(6)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。
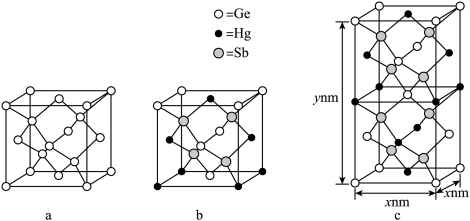
①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是_______ 。
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为_______ ;该晶胞中粒子个数比Hg∶Ge∶Sb=_______ 。

(1)基态硫原子价电子排布式为
(2)
 、
、 、
、 的沸点由高到低顺序为
的沸点由高到低顺序为(3)汞的原子序数为80,位于元素周期表第
(4)化合物Ⅲ也是一种汞解毒剂,化合物Ⅳ是一种强酸,下列说法正确的有
A.在Ⅰ中S原子采取
 杂化
杂化B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物Ⅰ与化合物Ⅲ相比水溶性较好的是
(6)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。

①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为
您最近一年使用:0次
解题方法
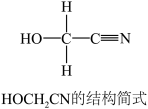
4 . [Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2-+4H++4H2O=[Zn(H2O)4]2++4HOCH2CN
(1)Zn2+基态核外电子排布式为__________________________ 。
(2)1mol HCHO分子中含有σ键的数目为__________ mol 。
(3)HOCH2CN分子中碳原子轨道的杂化类型是________________ 。
(4)与阴离子NH 互为等电子体的分子为
互为等电子体的分子为__________________ 。
(5)尿素晶体的晶胞结构如图所示,该晶胞中有___________ 个尿素分子。


(1)Zn2+基态核外电子排布式为
(2)1mol HCHO分子中含有σ键的数目为
(3)HOCH2CN分子中碳原子轨道的杂化类型是
(4)与阴离子NH
 互为等电子体的分子为
互为等电子体的分子为(5)尿素晶体的晶胞结构如图所示,该晶胞中有

您最近一年使用:0次
解题方法
5 . 高锰酸钾(KMnO4)被广泛用作氧化剂、消毒剂、水处理剂等。回答下列问题:
(1)基态锰原子的价电子排布式是_________ ,含有_________ 个未成对电子。
(2)高锰酸钾中各元素电负性的大小顺序为_________ 。
(3)已知元素Mn与Fe的第三电离能分别为:I3(Mn)=3248kJ/mol、I3(Fe)=2957kJ/mol,I3(Mn)>I3(Fe)的原因是_________ 。
(4)氧与硫位于相同主族,它们的最简单氢化物的沸点较高的是_________ ,其原因是_________ 。过氧化氢中氧原子的杂化方式为_________ 。
(5)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,如图所示。晶胞中K、I、O分别处于顶角、体心、面心位置,晶胞参数为a=0.446nm。

①距离K最近且距离相等的O有_________ 个;
②与I距离最近的O形成的空间构型为_________ 。
③已知A坐标(0,0,0),B坐标(1,1,1),则I的坐标为_________ ;
④与I距离最近的钾为_________ nm(已知 =1.732,计算结果保留小数点后三位有效数字)。
=1.732,计算结果保留小数点后三位有效数字)。
(1)基态锰原子的价电子排布式是
(2)高锰酸钾中各元素电负性的大小顺序为
(3)已知元素Mn与Fe的第三电离能分别为:I3(Mn)=3248kJ/mol、I3(Fe)=2957kJ/mol,I3(Mn)>I3(Fe)的原因是
(4)氧与硫位于相同主族,它们的最简单氢化物的沸点较高的是
(5)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,如图所示。晶胞中K、I、O分别处于顶角、体心、面心位置,晶胞参数为a=0.446nm。

①距离K最近且距离相等的O有
②与I距离最近的O形成的空间构型为
③已知A坐标(0,0,0),B坐标(1,1,1),则I的坐标为
④与I距离最近的钾为
 =1.732,计算结果保留小数点后三位有效数字)。
=1.732,计算结果保留小数点后三位有效数字)。
您最近一年使用:0次
6 . Ⅰ.完成下列选择题
(1)对于钠的卤化物(NaX)和硅的卤化物(SiX4)下列叙述正确的是________
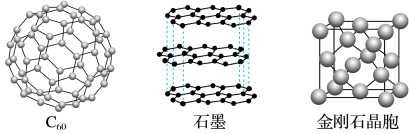
Ⅱ.碳元素单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
回答下列问题:
(2)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为_______ 。
(3)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为_______ 、_______ 。
(4)C60属于_______ 晶体,石墨属于_______ 晶体。
(5)石墨晶体中,层内C-C键的键长为142 pm,而金刚石中C-C键的键长为154 pm,其原因是金刚石中只存在C-C间_______ 共价键(σ或π),而石墨层内的C-C间不仅存在_______ 共价键(σ或π),还有_______ 键(σ或π)。
(6)金刚石晶胞含有_______ 个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=_______ a,列式表示碳原子在晶胞中的空间占有率_______ (不要求计算结果)。
(1)对于钠的卤化物(NaX)和硅的卤化物(SiX4)下列叙述正确的是________
| A.SiX4是离子晶体 | B.SiX4是共价化合物 |
| C.NaX不溶于水 | D.NaX的熔点一般高于SiX4 |
Ⅱ.碳元素单质有多种形式,下图依次是C60、石墨和金刚石的结构图:

回答下列问题:
(2)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为
(3)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为
(4)C60属于
(5)石墨晶体中,层内C-C键的键长为142 pm,而金刚石中C-C键的键长为154 pm,其原因是金刚石中只存在C-C间
(6)金刚石晶胞含有
您最近一年使用:0次
7 . 工业上常用尿素[CO(NH2)2]和NaClO溶液反应制备水合肼。水合肼(N2H4·H2O)可用作抗氧剂等。
已知:I.N2H4·H2O的结构如图(…表示氢键)。

II.N2H4·H2O沸点118℃,具有强还原性。
(1)将Cl2通入过量NaOH溶液中制备NaClO,得到溶液X,离子方程式是_______ 。
(2)制备水合肼:将溶液X滴入尿素水溶液中,控制一定温度,装置如下图(夹持及控温装置已略)。充分反应后,A中的溶液经蒸馏获得水合肼粗品后,剩余溶液再进一步处理还可获得副产品NaCl和Na2CO3·10H2O。

①A中反应的化学方程式是_______ 。
②冷凝管的作用是_______ 。
③若滴加NaClO溶液的速度较快时,水合肼的产率会下降,原因是_______ 。
(3)水合肼在溶液中可发生类似NH3·H2O的电离,呈弱碱性;其分子中与N原子相连的H原子易发生取代反应。
①水合肼和盐酸按物质的量之比1∶1反应的离子方程式是_______ 。
②碳酰肼(CH6N4O)是目前去除锅炉水中氧气的最先进材料,由水合肼与DEC( )发生取代反应制得。碳酰肼的结构简式是
)发生取代反应制得。碳酰肼的结构简式是_______ 。
(4)尿素还可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(III),化学式为[Fe(H2NCONH2)6](NO3)3。
①C、N、O三种元素的第一电离能由大到小的顺序是_______ 。
②尿素分子中C和N原子的杂化方式分别是_______ 、_______ 。
③[Fe(H2NCONH2)6](NO3)3中H2NCONH2与Fe(III)之间的作用力是_______ 。
④FeCl3溶液与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是_______ 。
已知:I.N2H4·H2O的结构如图(…表示氢键)。

II.N2H4·H2O沸点118℃,具有强还原性。
(1)将Cl2通入过量NaOH溶液中制备NaClO,得到溶液X,离子方程式是
(2)制备水合肼:将溶液X滴入尿素水溶液中,控制一定温度,装置如下图(夹持及控温装置已略)。充分反应后,A中的溶液经蒸馏获得水合肼粗品后,剩余溶液再进一步处理还可获得副产品NaCl和Na2CO3·10H2O。

①A中反应的化学方程式是
②冷凝管的作用是
③若滴加NaClO溶液的速度较快时,水合肼的产率会下降,原因是
(3)水合肼在溶液中可发生类似NH3·H2O的电离,呈弱碱性;其分子中与N原子相连的H原子易发生取代反应。
①水合肼和盐酸按物质的量之比1∶1反应的离子方程式是
②碳酰肼(CH6N4O)是目前去除锅炉水中氧气的最先进材料,由水合肼与DEC(
 )发生取代反应制得。碳酰肼的结构简式是
)发生取代反应制得。碳酰肼的结构简式是(4)尿素还可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(III),化学式为[Fe(H2NCONH2)6](NO3)3。
①C、N、O三种元素的第一电离能由大到小的顺序是
②尿素分子中C和N原子的杂化方式分别是
③[Fe(H2NCONH2)6](NO3)3中H2NCONH2与Fe(III)之间的作用力是
④FeCl3溶液与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是
您最近一年使用:0次
8 . 元素X、Y、Z为前四周期元素,X的基态原子核外电子有21种运动状态,元素Y的原子最外层电子数是其内层的3倍,Z与X、Y不在同一周期,且Z原子核外p电子比s电子多5个。
(1)X基态原子的核外电子排布式为_______ ,Y的原子结构示意图_______ 。
(2)X是石油化工中重要的催化剂之一,如催化异丙苯( )裂化生成苯和丙烯。
)裂化生成苯和丙烯。
① 1 mol苯分子中含有σ 键的数目为_______ mol。
② 异丙苯分子中碳原子轨道的杂化类型为_______ 。
(3)Y的氢化物沸点高于同族氢化物沸点的原因_______ 。
(4)XZ3易溶于水,熔点为960 ℃,熔融状态下能够导电,据此可判断XY3晶体属于_______ (填晶体类型)。
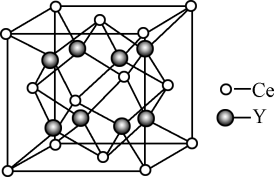
(5)元素Ce与X同族,其与Y形成的化合物晶体的晶胞结构如下图,该化合物的化学式为_______ 。
(1)X基态原子的核外电子排布式为
(2)X是石油化工中重要的催化剂之一,如催化异丙苯(
 )裂化生成苯和丙烯。
)裂化生成苯和丙烯。① 1 mol苯分子中含有σ 键的数目为
② 异丙苯分子中碳原子轨道的杂化类型为
(3)Y的氢化物沸点高于同族氢化物沸点的原因
(4)XZ3易溶于水,熔点为960 ℃,熔融状态下能够导电,据此可判断XY3晶体属于
(5)元素Ce与X同族,其与Y形成的化合物晶体的晶胞结构如下图,该化合物的化学式为

您最近一年使用:0次
解题方法
9 . 研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_______ 。元素Mn与O中,第一电离能较大的是_______ ,基态原子核外未成对电子数较多的是_______ 。
(2)CO2和CH3OH分子中C原子的杂化形式分别为_______ 和_______ 。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_______
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在_______ 。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为_______ nm。MnO也属于NaCl型结构,晶胞参数为a′=0.448 nm,则r(Mn2+)为_______ nm。
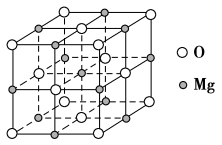
(1)Co基态原子核外电子排布式为
(2)CO2和CH3OH分子中C原子的杂化形式分别为
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为

您最近一年使用:0次
解题方法
10 . 回答下列问题:
(1)若BCl3与XYn通过B原子与X原子间的配位键结合形成配合物,则该配合物提供孤电子对的原子是___________ 。
(2)NH3与BF3可以通过配位键形成NH3·BF3___________ 原子提供孤电子对,___________ 原子提供空轨道。写出NH3·BF3的结构式,并用“→”表示出配位键___________ 。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内存在___________ (填序号)。
a.离子键 b.配位键 c.共价键
(4)向盛有硫酸铜溶液的试管中滴加氨水,先生成难溶物,继续滴加氨水,难溶物溶解,得到深蓝色透明溶液。下列对此现象的说法正确的是___________。
(5)向氯化铜溶液中加入过量浓氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]Cl2晶体,深蓝色晶体中含有的化学键除普通的共价键外,还有___________ 和___________ 。
(1)若BCl3与XYn通过B原子与X原子间的配位键结合形成配合物,则该配合物提供孤电子对的原子是
(2)NH3与BF3可以通过配位键形成NH3·BF3
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内存在
a.离子键 b.配位键 c.共价键
(4)向盛有硫酸铜溶液的试管中滴加氨水,先生成难溶物,继续滴加氨水,难溶物溶解,得到深蓝色透明溶液。下列对此现象的说法正确的是___________。
| A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
| B.沉淀溶解后,生成深蓝色的配离子[Cu(NH3)4]2+ |
| C.[Cu(NH3)4]2+的立体构型为正四面体形 |
| D.在[Cu(NH3)4]2+配离子中,Cu2+给出孤电子对,NH3提供空轨道 |
您最近一年使用:0次



