名校
1 . 卤族元素的单质和化合物在生产生活中有重要的用途。请回答:
(1)卤素元素位于元素周期表的___________ 区,溴原子的原子核外有___________ 种不同运动状态的电子,其M能层电子排布式为___________ 。
(2) 中心原子的杂化类型为
中心原子的杂化类型为___________ , 的空间构型为
的空间构型为___________ 。
(3)一定条件下 与
与 以物质的量之比为
以物质的量之比为 混舍得到一种固态离子化合物,其结构组成可能为:(a)
混舍得到一种固态离子化合物,其结构组成可能为:(a)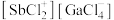 或(b)
或(b)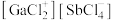 ,该离子化合物最可能的结构组成为
,该离子化合物最可能的结构组成为___________ (填“a”或“b”),理由是___________ 。
(4)在离子晶体中,当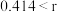 (阳离子)
(阳离子)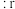 (阴离子)
(阴离子)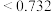 时,
时, 型化合物往往采用和
型化合物往往采用和 晶体相同的晶体结构(如下图1)。已知
晶体相同的晶体结构(如下图1)。已知 ,但在室温下,
,但在室温下, 的晶体结构如下图2所示,称为六方碘化银。
的晶体结构如下图2所示,称为六方碘化银。 的配位数为
的配位数为___________ ,造成 晶体结构不同于
晶体结构不同于 晶体结构的原因不可能是
晶体结构的原因不可能是___________ 。
a.几何因素 b.电荷因素 c.键性因素
若六方碘化银晶胞底边边长为 ,高为
,高为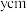 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,碘化银晶体的密度为
,碘化银晶体的密度为___________ 列出计算式。
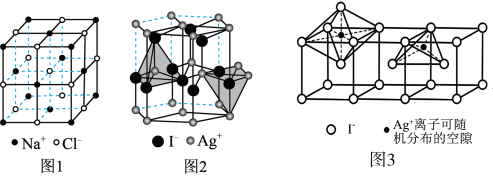
(5)当温度处于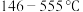 间时,六方碘化银转化为
间时,六方碘化银转化为 (如图3),
(如图3), 可随机地分布在四面体空隙和八面体空隙中,多面体空隙间又彼此共面相连,则在
可随机地分布在四面体空隙和八面体空隙中,多面体空隙间又彼此共面相连,则在 晶体中,
晶体中, (八面体空隙):n(四面体空隙)=
(八面体空隙):n(四面体空隙)=___________ 。
(1)卤素元素位于元素周期表的
(2)
 中心原子的杂化类型为
中心原子的杂化类型为 的空间构型为
的空间构型为(3)一定条件下
 与
与 以物质的量之比为
以物质的量之比为 混舍得到一种固态离子化合物,其结构组成可能为:(a)
混舍得到一种固态离子化合物,其结构组成可能为:(a)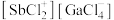 或(b)
或(b)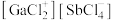 ,该离子化合物最可能的结构组成为
,该离子化合物最可能的结构组成为(4)在离子晶体中,当
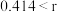 (阳离子)
(阳离子)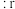 (阴离子)
(阴离子)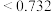 时,
时, 型化合物往往采用和
型化合物往往采用和 晶体相同的晶体结构(如下图1)。已知
晶体相同的晶体结构(如下图1)。已知 ,但在室温下,
,但在室温下, 的晶体结构如下图2所示,称为六方碘化银。
的晶体结构如下图2所示,称为六方碘化银。 的配位数为
的配位数为 晶体结构不同于
晶体结构不同于 晶体结构的原因不可能是
晶体结构的原因不可能是a.几何因素 b.电荷因素 c.键性因素
若六方碘化银晶胞底边边长为
 ,高为
,高为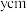 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,碘化银晶体的密度为
,碘化银晶体的密度为
(5)当温度处于
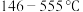 间时,六方碘化银转化为
间时,六方碘化银转化为 (如图3),
(如图3), 可随机地分布在四面体空隙和八面体空隙中,多面体空隙间又彼此共面相连,则在
可随机地分布在四面体空隙和八面体空隙中,多面体空隙间又彼此共面相连,则在 晶体中,
晶体中, (八面体空隙):n(四面体空隙)=
(八面体空隙):n(四面体空隙)=
您最近一年使用:0次
2 . 金属铜、铁在日常生活中应用广泛,根据下列说法回答下列问题。
(1) 的制备反应为
的制备反应为 。
。
上述氧化过程中, (II)
(II)_____ (答简化电子排布式)变为 III)
III)_____ (答外围电子排布图),基态 (III)电子占据
(III)电子占据_____ 个不同轨道。
(2)对上述反应式中的短周期元素按照电负性由小到大排序为_____
(3)配合物 的配位数为6,其配体
的配位数为6,其配体 中的
中的 的杂化方式为
的杂化方式为_____ 杂化。
(4)铜原子与氯原子形成化合物的晶胞如图所示(黑球代表铜原子,白球表示氯原子)。
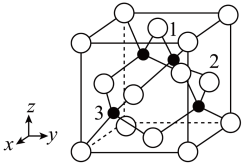
①已知铜和氯的电负性分别为1.9和3.0,则铜与氯形成的化合物属于_____ (填“离子”或“共价”)化合物。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1的坐标为( ,
, ,1),则原子2和3的坐标分别为
,1),则原子2和3的坐标分别为_____ 、_____ 。
③已知该晶体的密度为 ,阿伏加德罗常数为NA,则该晶体中铜原子和氯原子的最短距离为
,阿伏加德罗常数为NA,则该晶体中铜原子和氯原子的最短距离为_____ pm(只写计算式)。
(1)
 的制备反应为
的制备反应为 。
。上述氧化过程中,
 (II)
(II) III)
III) (III)电子占据
(III)电子占据(2)对上述反应式中的短周期元素按照电负性由小到大排序为
(3)配合物
 的配位数为6,其配体
的配位数为6,其配体 中的
中的 的杂化方式为
的杂化方式为(4)铜原子与氯原子形成化合物的晶胞如图所示(黑球代表铜原子,白球表示氯原子)。

①已知铜和氯的电负性分别为1.9和3.0,则铜与氯形成的化合物属于
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1的坐标为(
 ,
, ,1),则原子2和3的坐标分别为
,1),则原子2和3的坐标分别为③已知该晶体的密度为
 ,阿伏加德罗常数为NA,则该晶体中铜原子和氯原子的最短距离为
,阿伏加德罗常数为NA,则该晶体中铜原子和氯原子的最短距离为
您最近一年使用:0次
名校
解题方法
3 . 硫酸是重要的化工原料,我国主要采用接触法生产硫酸,主要过程如下:
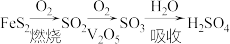
(1)基态 原子核外未成对电子数为
原子核外未成对电子数为_______ , 溶液是检验
溶液是检验 的常用试剂,
的常用试剂, 中
中 原子的杂化类型为
原子的杂化类型为_______ , 中含有的
中含有的 键与
键与 键的数目之比为
键的数目之比为_______ 。
(2)分子中的大 键可用符号
键可用符号 表示,其中
表示,其中 代表参与形成大键的原子数,
代表参与形成大键的原子数, 代表参与形成大
代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),已知
),已知 分子中含有5对孤电子对,则
分子中含有5对孤电子对,则 中的大
中的大 键应表示为
键应表示为_______ 。 分子中键角
分子中键角
_______ 键角 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
(3) 分子的空间构型为
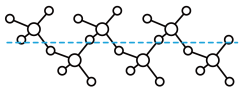
分子的空间构型为_______ 。固态 能以无限长链形式存在(如图所示),长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是
能以无限长链形式存在(如图所示),长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是_______ (填“桥氧”或“端基氧”)。
(4)绿矾是一种重要的硫酸盐,其组成可写成 ,则绿矾中含有的微粒间作用力有_______。
,则绿矾中含有的微粒间作用力有_______。
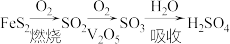
(1)基态
 原子核外未成对电子数为
原子核外未成对电子数为 溶液是检验
溶液是检验 的常用试剂,
的常用试剂, 中
中 原子的杂化类型为
原子的杂化类型为 中含有的
中含有的 键与
键与 键的数目之比为
键的数目之比为(2)分子中的大
 键可用符号
键可用符号 表示,其中
表示,其中 代表参与形成大键的原子数,
代表参与形成大键的原子数, 代表参与形成大
代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),已知
),已知 分子中含有5对孤电子对,则
分子中含有5对孤电子对,则 中的大
中的大 键应表示为
键应表示为 分子中键角
分子中键角
 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。(3)
 分子的空间构型为
分子的空间构型为 能以无限长链形式存在(如图所示),长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是
能以无限长链形式存在(如图所示),长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是
(4)绿矾是一种重要的硫酸盐,其组成可写成
 ,则绿矾中含有的微粒间作用力有_______。
,则绿矾中含有的微粒间作用力有_______。| A.离子键 | B.共价键 | C.配位键 | D.氢键 |
您最近一年使用:0次
名校
解题方法
4 . 合成氨反应被誉为人类历史上最具跨时代意义的化学反应。
(1)比较大小(填写“>”或“<”):
①熔沸点:
_______  ②稳定性:
②稳定性:
_______  ③共价键的极性:
③共价键的极性:
_______ 
(2)合成氨工厂常用醋酸二氨合铜(由 和
和 构成)溶液吸收对氨合成催化剂有毒害的
构成)溶液吸收对氨合成催化剂有毒害的 气体。
气体。
①醋酸二氨合铜所含的元素中,第一电离能最大的是_______ 。
②醋酸二氨合铜所含的金属阳离子的价电子排布式为_______ 。
③在水溶液中, 离子比
离子比 稳定,常以
稳定,常以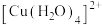 形式存在,向含
形式存在,向含 离子的溶液中加入氨水,可生成更稳定的
离子的溶液中加入氨水,可生成更稳定的 离子,其原因是
离子,其原因是_______ 。
(3) 与
与 气体相遇立即生成白色晶体:
气体相遇立即生成白色晶体: 。
。
①晶体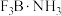 中,
中, 原子的杂化轨道类型为
原子的杂化轨道类型为_______ 。
②写出一种与 具有相同空间构型的阴离子
具有相同空间构型的阴离子___ 。
(4)合成氨工业中,为了增大平衡时H2的转化率,可采取的措施是___ 。
A.增大压强 B.使用合适的催化剂 C.升高温度
D.增大氢气的浓度 E.及时分离出产物中的
(5)常温下,将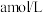 的氨水和
的氨水和 的稀盐酸等体积混合,溶液呈中性,则
的稀盐酸等体积混合,溶液呈中性,则
①混合前盐酸中 和氨水中
和氨水中 的关系
的关系
_______  (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
②一水合氨的电离常数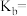
_______ 。
(1)比较大小(填写“>”或“<”):
①熔沸点:

 ②稳定性:
②稳定性:
 ③共价键的极性:
③共价键的极性:

(2)合成氨工厂常用醋酸二氨合铜(由
 和
和 构成)溶液吸收对氨合成催化剂有毒害的
构成)溶液吸收对氨合成催化剂有毒害的 气体。
气体。①醋酸二氨合铜所含的元素中,第一电离能最大的是
②醋酸二氨合铜所含的金属阳离子的价电子排布式为
③在水溶液中,
 离子比
离子比 稳定,常以
稳定,常以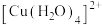 形式存在,向含
形式存在,向含 离子的溶液中加入氨水,可生成更稳定的
离子的溶液中加入氨水,可生成更稳定的 离子,其原因是
离子,其原因是(3)
 与
与 气体相遇立即生成白色晶体:
气体相遇立即生成白色晶体: 。
。①晶体
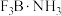 中,
中, 原子的杂化轨道类型为
原子的杂化轨道类型为②写出一种与
 具有相同空间构型的阴离子
具有相同空间构型的阴离子(4)合成氨工业中,为了增大平衡时H2的转化率,可采取的措施是
A.增大压强 B.使用合适的催化剂 C.升高温度
D.增大氢气的浓度 E.及时分离出产物中的

(5)常温下,将
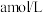 的氨水和
的氨水和 的稀盐酸等体积混合,溶液呈中性,则
的稀盐酸等体积混合,溶液呈中性,则①混合前盐酸中
 和氨水中
和氨水中 的关系
的关系
 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。②一水合氨的电离常数
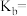
您最近一年使用:0次
5 . 钛(Ti)及其化合物的应用研究是目前前沿科学之一,请回答下列问题:
(1)基态钛原子的电子排布式为_______ 。
(2) 作光催化剂可将甲醛、苯等有害气体转化为
作光催化剂可将甲醛、苯等有害气体转化为 和
和 。上述含碳原子的分子中,碳原子的杂化方式为
。上述含碳原子的分子中,碳原子的杂化方式为 的是
的是_______ (填名称)。
(3)作为过渡元素的Fe、Cu容易形成配位化合物,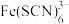 中C、N两种元素的电负性大小关系为
中C、N两种元素的电负性大小关系为_______ 。硫酸铜稀溶液中微粒间不存在的作用力有_______ (填序号)。
A.配位键 B.金属键 C.离子键 D.共价键 E.氢键 F.范德华力
(4)已知Ba、Mo的氯化物沸点信息如下表所示。二者沸点差异的原因是_______ 。
(5) 分子中H-N-H的键角为107°,在
分子中H-N-H的键角为107°,在 中,H-N-H键角近似109.5°,键角变大的原因是
中,H-N-H键角近似109.5°,键角变大的原因是_______ 。
(6)贵金属磷化物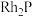 (化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为
(化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为_______ ,晶体的密度为_______  。(列出计算式即可)。
。(列出计算式即可)。

(1)基态钛原子的电子排布式为
(2)
 作光催化剂可将甲醛、苯等有害气体转化为
作光催化剂可将甲醛、苯等有害气体转化为 和
和 。上述含碳原子的分子中,碳原子的杂化方式为
。上述含碳原子的分子中,碳原子的杂化方式为 的是
的是(3)作为过渡元素的Fe、Cu容易形成配位化合物,
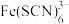 中C、N两种元素的电负性大小关系为
中C、N两种元素的电负性大小关系为A.配位键 B.金属键 C.离子键 D.共价键 E.氢键 F.范德华力
(4)已知Ba、Mo的氯化物沸点信息如下表所示。二者沸点差异的原因是
| 氯化物 | 沸点 |
 | 1560℃ |
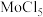 | 268℃ |
(5)
 分子中H-N-H的键角为107°,在
分子中H-N-H的键角为107°,在 中,H-N-H键角近似109.5°,键角变大的原因是
中,H-N-H键角近似109.5°,键角变大的原因是(6)贵金属磷化物
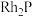 (化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为
(化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为 。(列出计算式即可)。
。(列出计算式即可)。
您最近一年使用:0次
名校
解题方法
6 . 过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(1)Cr 是第___________ 周期第___________ 族元素。
(2)基态 Cr 原子的核外电子有___________ 种空间运动状态,有___________ 个未成对电子。
(3)Cr3+能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中,中心离子的配位数为___________ 。
(4)[Cr(NH3)3(H2O)2Cl]2+的配体分子 NH3 中 N 的杂化轨道类型是___________ ,H2O 的键角小于 NH3,原因是___________ 。
(5)在金属材料中添加 AlCr2 颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2 具有体心四方结构,如下图所示,处于顶角位置的是___________ 原子。若 NA 表示阿伏加德罗常数的值,则该晶体的密度为___________ g∙cm−3(用含 a、c 和 NA 的代数式表示)。晶胞中长、宽为a nm,高为c nm。
(1)Cr 是第
(2)基态 Cr 原子的核外电子有
(3)Cr3+能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中,中心离子的配位数为
(4)[Cr(NH3)3(H2O)2Cl]2+的配体分子 NH3 中 N 的杂化轨道类型是
(5)在金属材料中添加 AlCr2 颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2 具有体心四方结构,如下图所示,处于顶角位置的是

您最近一年使用:0次
2022-01-07更新
|
350次组卷
|
3卷引用:天津市南开区2021-2022学年高三上学期期末考试化学试卷
名校
解题方法
7 . 世界上首个五氮阴离子盐是(N5)6(H3O)3(NH4)4Cl(用R代表)。经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。回答下列问题:

(1)基态氮原子的价电子的轨道表达式为_______ 。
(2)从结构角度分析,R中两种阳离子的相同之处为_______。(填标号)
(3)R中阴离子N 中的σ键总数为
中的σ键总数为_______ 个。分子中的大π键可用符号 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为 ),则N
),则N 中的大π键应表示为
中的大π键应表示为_______ 。
(4)图中虚线代表氢键,其表示式为(H3O+)O—H…N、_______ 、_______ 。

(1)基态氮原子的价电子的轨道表达式为
(2)从结构角度分析,R中两种阳离子的相同之处为_______。(填标号)
| A.中心原子的杂化轨道类型 | B.中心原子的价层电子对数 |
| C.VSEPR模型名称 | D.共价键类型 |
 中的σ键总数为
中的σ键总数为 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为 ),则N
),则N 中的大π键应表示为
中的大π键应表示为(4)图中虚线代表氢键,其表示式为(H3O+)O—H…N、
您最近一年使用:0次
名校
解题方法
8 . 很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。
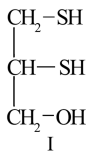

(1)H2S、CH4、H2O的沸点由高到低顺序为_______ 。
(2)汞的原子序数为80,位于元素周期表第_______ 周期第_______ 族。
(3)化合物Ⅳ是一种强酸,请基于理论比较IV和硫酸的pKa1:化合物IV_______ 硫酸(填“>”或“<”)
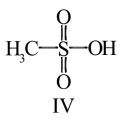
(4)化合物Ⅲ也是一种汞解毒剂。下列关于上述物质的说法正确的有_______ 。
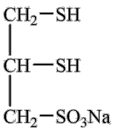
Ⅲ
A.在I和Ⅲ中S原子均采取sp3杂化
B.在Ⅱ中所有元素中S元素的电负性最大
C.在Ⅲ中C—C—C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的物质是_______ 。(填“化合物I”或“化合物Ⅲ”)


(1)H2S、CH4、H2O的沸点由高到低顺序为
(2)汞的原子序数为80,位于元素周期表第
(3)化合物Ⅳ是一种强酸,请基于理论比较IV和硫酸的pKa1:化合物IV

(4)化合物Ⅲ也是一种汞解毒剂。下列关于上述物质的说法正确的有

Ⅲ
A.在I和Ⅲ中S原子均采取sp3杂化
B.在Ⅱ中所有元素中S元素的电负性最大
C.在Ⅲ中C—C—C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的物质是
您最近一年使用:0次
解题方法
9 . 圆明园十二生肖兽首都是用铜质材料铸造而成的,我国铜的应用与冶炼由来已久,西汉刘安的《淮南万毕术》中有“曾青得铁则化为铜”,这是湿法治金的雏形。
(1)基态铁原子的电子排布式为___________ ;基态的 有
有___________ 个未成对电子。
(2)向硫酸铜溶液中滴加过量的氨水可形成 深蓝色溶液。
深蓝色溶液。
① 和
和 之间形成的化学键称为
之间形成的化学键称为___________ ,提供孤电子对的原子是___________ (填名称)。
② 中阴离子的立体构型是
中阴离子的立体构型是___________ 。
③氨的沸点___________ (填“高于”“低于”或“等于”)膦( )的,原因是
)的,原因是___________ ; 是
是___________ 分子(填“极性”或“非极性”),中心原子的轨道杂化类型为___________ 。
(3)铁和铜都是___________ 晶体(填“离子”“分子”“原子”或“金属”); 的第三电离能(
的第三电离能( )、第四电离能(
)、第四电离能( )分别为
)分别为 、
、 ,
, 的原因是
的原因是___________ 。
(4)铜晶胞如图所示。已知: 代表阿伏加德罗常数的值,铜晶胞的密度为
代表阿伏加德罗常数的值,铜晶胞的密度为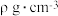 。
。

①铜原子半径为 ,则
,则
___________ 。
②铜晶胞的空间利用率为___________ 。(注明:晶胞的空间利用率 )
)
(1)基态铁原子的电子排布式为
 有
有(2)向硫酸铜溶液中滴加过量的氨水可形成
 深蓝色溶液。
深蓝色溶液。①
 和
和 之间形成的化学键称为
之间形成的化学键称为②
 中阴离子的立体构型是
中阴离子的立体构型是③氨的沸点
 )的,原因是
)的,原因是 是
是(3)铁和铜都是
 的第三电离能(
的第三电离能( )、第四电离能(
)、第四电离能( )分别为
)分别为 、
、 ,
, 的原因是
的原因是(4)铜晶胞如图所示。已知:
 代表阿伏加德罗常数的值,铜晶胞的密度为
代表阿伏加德罗常数的值,铜晶胞的密度为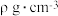 。
。
①铜原子半径为
 ,则
,则
②铜晶胞的空间利用率为
 )
)
您最近一年使用:0次
10 . 回答下列问题:
(1)尖晶石型过渡金属硫化物CuCo2S4由于具有较高的导电能力,辉钼(MoS2)被认为是极有希望代替最佳析氢电催化剂Pt的廉价过渡金属基催化材料,CuCo2S4和MoS2复合有望提高其电子传导效率并提升电催化活性,得到CuCo2S4—MoS2被广泛用于电化学领域。
①基态Cu原子的价层电子排布式为___ 。Co在周期表中的位置为___ ;基态S原子电子占据最高能级的电子云轮廓图为___ 形。
②Mo位于周期表第五周期ⅥB族,基态Mo原子核外有___ 种不同运动状态的电子。MoS2纳米粒子具有类似于石墨的层状结构,具有优异的润滑性能,其原因是___ 。
③Co原子通常用光谱分析法来鉴定,其原理是___ 。
(2)2,6—二甲基吡啶的锰合物是有机化学中常见的催化剂,其结构如图所示,回答下列问题:

①在该配合物中,Mn提供___ 。
②写出CO的等电子体___ (写2种)。
③该配合物中N的杂化方式为___ 。
(1)尖晶石型过渡金属硫化物CuCo2S4由于具有较高的导电能力,辉钼(MoS2)被认为是极有希望代替最佳析氢电催化剂Pt的廉价过渡金属基催化材料,CuCo2S4和MoS2复合有望提高其电子传导效率并提升电催化活性,得到CuCo2S4—MoS2被广泛用于电化学领域。
①基态Cu原子的价层电子排布式为
②Mo位于周期表第五周期ⅥB族,基态Mo原子核外有
③Co原子通常用光谱分析法来鉴定,其原理是
(2)2,6—二甲基吡啶的锰合物是有机化学中常见的催化剂,其结构如图所示,回答下列问题:

①在该配合物中,Mn提供
②写出CO的等电子体
③该配合物中N的杂化方式为
您最近一年使用:0次



