名校
解题方法
1 . A、B、C、D、E、F为原子序数依次增大的前四周期元素,A元素原子最外层电子数是其内层电子数的2.5倍,B元素是地壳中含量最高的元素,C元素的最高化合价和最低化合价的代数和等于0,D元素的单质可用于自来水消毒杀菌,E元素位于周期表的ⅥB族,F的基态原子中有4个未成对电子。
(1)A元素单质的结构式为_______ ;基态E元素原子价层电子排布图为_______ 。
(2)在A的氢化物A2H4分子中,A原子轨道的杂化类型是_______ ;A与B形成的A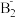 的立体构型为
的立体构型为_______ 。
(3)火箭推动剂由A2H4和H2B2组成,加热反应时有A元素的单质生成,写出该化学反应方程式:_______ 。
(4)写出酸性条件下,E元素的离子E2 和D元素的阴离子反应的离子方程式:
和D元素的阴离子反应的离子方程式:_______ 。
(5)基态F3+未成对电子数为_______ 个;F3+与SCN—络合得到多种配合物,其中配位数为5的配合物的阴离子为_______ (填化学式)。
(6)元素B与E形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。若晶胞参数为a pm,NA为阿伏加德罗常数的值,则该晶胞的密度为_______ g·cm-3。

(1)A元素单质的结构式为
(2)在A的氢化物A2H4分子中,A原子轨道的杂化类型是
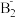 的立体构型为
的立体构型为(3)火箭推动剂由A2H4和H2B2组成,加热反应时有A元素的单质生成,写出该化学反应方程式:
(4)写出酸性条件下,E元素的离子E2
 和D元素的阴离子反应的离子方程式:
和D元素的阴离子反应的离子方程式:(5)基态F3+未成对电子数为
(6)元素B与E形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。若晶胞参数为a pm,NA为阿伏加德罗常数的值,则该晶胞的密度为

您最近一年使用:0次
名校
解题方法
2 . 已知A、B、C、D都是周期表中的短周期元素,它们的核电荷数依次增大。A原子、C原子的L能层中都有两个未成对的电子,C、D同主族。E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)D的最高价氧化物的空间构型为_________ 。
(2)E2+的价层电子排布图是___________ ,F原子的电子排布式是___________ 。
(3)A的最高价氧化物对应的水化物分子结构式为_______ ,其中心原子采取的轨道杂化方式为_________ ,B的简单气态氢化物的空间构型经过分析为三角锥形,判断依据是_________ 。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,含DAB-的水溶液可以用于实验室中E3+的定性检验,检验E3+的离子方程式为________ 。
(1)D的最高价氧化物的空间构型为
(2)E2+的价层电子排布图是
(3)A的最高价氧化物对应的水化物分子结构式为
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,含DAB-的水溶液可以用于实验室中E3+的定性检验,检验E3+的离子方程式为
您最近一年使用:0次
解题方法
3 . 已知X、Y、Z、W、Q是前四周期的核电荷数依次增大的元素,X的价电子层中有3个未成对电子,X与Z同主族;Y与W同主族,W元素原子M层有两对成对电子;Q的最外层只有1个电子,但次外层有18个电子。
(1)X、Y、W的第一电离能由大到小的顺序是__ (填字母对应的元素符号)。
(2)已知元素Z的某钾盐(KH2ZO4)是其酸(H3ZO2)的正盐,则酸H3ZO2的结构式为__ (元素Z用对应的元素符号书写)。
(3)已知元素X、Z相关键的键能(kJ•mol-1)如表:从能量角度看,X元素形成的单质以X2、而Z元素形成的单质Z4(结构式可表示为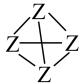 )形式存在的原因是
)形式存在的原因是__ 。
(4)元素W的含氧酸根离子(WO )的空间构型为
)的空间构型为__ ,与之互为等电子体的阴离子有__ (写出一种离子符号;等电子体指化学通式相同且价电子总数相等的分子或离子)。
(5)对于基态Q原子,下列叙述正确的是__ (填标号)。
(6)向盛有QSO4水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。分离出所得溶质化合物[Q(NH3)4(H2O)2]SO4,然后加热该化合物固体,首先失去的组分是__ ,理由是__ 。
(1)X、Y、W的第一电离能由大到小的顺序是
(2)已知元素Z的某钾盐(KH2ZO4)是其酸(H3ZO2)的正盐,则酸H3ZO2的结构式为
(3)已知元素X、Z相关键的键能(kJ•mol-1)如表:从能量角度看,X元素形成的单质以X2、而Z元素形成的单质Z4(结构式可表示为
 )形式存在的原因是
)形式存在的原因是| X—X | X≡X | Z—Z | Z≡Z |
| 193 | 946 | 197 | 489 |
 )的空间构型为
)的空间构型为(5)对于基态Q原子,下列叙述正确的是
| A.遵循能量最低原理,核外电子排布应为[Ar]3d94s2 |
| B.排布在外层的电子总是比排布在内层的电子离核更远 |
| C.电负性比钾高,原子对键合电子的吸引力比钾大 |
| D.电子先排入4s轨道,再排进3d轨道,故3d轨道的电子能量比4s高 |
您最近一年使用:0次
名校
4 . 已知A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素,E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子。G元素最大能层符号为N,有4个单电子。
(1)基态E原子的价电子排布图___________ 。
(2)B、C、D三元素第一电离能由大到小的顺序为___________ (用元素符号表示)。
(3) 中心原子为
中心原子为___________ 杂化,空间构型为___________ ,键角___________  (用“>、<、=”填空)。
(用“>、<、=”填空)。
(4) 与C2为等电子体结构相似,1mol
与C2为等电子体结构相似,1mol 中含有
中含有 键的数目为
键的数目为___________ 。
(5)D、E元素最简单氢化物的稳定性___________ (填化学式)。
(6)基态G2+离子的电子排布式为:___________ 。
(1)基态E原子的价电子排布图
(2)B、C、D三元素第一电离能由大到小的顺序为
(3)
 中心原子为
中心原子为 (用“>、<、=”填空)。
(用“>、<、=”填空)。(4)
 与C2为等电子体结构相似,1mol
与C2为等电子体结构相似,1mol 中含有
中含有 键的数目为
键的数目为(5)D、E元素最简单氢化物的稳定性
(6)基态G2+离子的电子排布式为:
您最近一年使用:0次
解题方法
5 . W、X、Y、Z、M、Q是元素周期表中前四周期的元素,原子序数依次增大,其有关信息如表所示:
回答下列问题:
(1)X核外电子的运动状态有___________ 种。
(2)M基态原子的电子排布式为___________ 。
(3)基态Q2+的价电子轨道表示式为___________ 。
(4)M的第一电离能___________ (填“大于”或“小于”)Q的第一电离能,原因为___________ 。
(5)[Q(Y2W4)2(Y3)2]n是一种应用广泛的配合物,其结构式为 ,其中Y2W4、Y
,其中Y2W4、Y 是两种配体,中心Q离子的配位数为
是两种配体,中心Q离子的配位数为___________ 。Y2W4的电子式为___________ 。Y 中心原子的杂化类型为
中心原子的杂化类型为___________ 。
(6)Y的简单氢化物极易溶于Z的简单氢化物的原因与氢键有关,所形成的化合物分子合理的结构式为___________ ,理由是___________ 。
| 元素 | 相关信息 |
| W | 核外电子数与其电子层数相同 |
| X | 最外层电子数是核外电子总数的一半 |
| Y | 原子核外p电子数比s电子数少1 |
| Z | Z2−与Ne具有相同的电子层结构 |
| M | 原子序数为X、Y、Z三者原子序数之和 |
| Q | 过渡元素,基态原子核外没有未成对电子 |
(1)X核外电子的运动状态有
(2)M基态原子的电子排布式为
(3)基态Q2+的价电子轨道表示式为
(4)M的第一电离能
(5)[Q(Y2W4)2(Y3)2]n是一种应用广泛的配合物,其结构式为
 ,其中Y2W4、Y
,其中Y2W4、Y 是两种配体,中心Q离子的配位数为
是两种配体,中心Q离子的配位数为 中心原子的杂化类型为
中心原子的杂化类型为(6)Y的简单氢化物极易溶于Z的简单氢化物的原因与氢键有关,所形成的化合物分子合理的结构式为
您最近一年使用:0次
名校
解题方法
6 . G、M、R、X、Y、W、Q、T为原子序数依次增大的前四周期元素。G的一种简单粒子是一个质子,M基态原子L层中p轨道电子数是s轨道电子数的2倍,R原子K层的电子数与M层的电子数的乘积等于其L层的电子数,X和M是同主族元素,Y与X同周期且相邻,W是第一种过渡元素,Q位于第ⅠB族,T元素最高正价和最低负价的代数和为4.请回答下列问题:
(1)W的元素符号___________ ,Q在周期表中第___________ 列,T基态原子的简化电子排布式是___________ 。
(2)X与M形成的XM3分子的VSEPR模型是_______ ,GYM的电子式为________ 。
(3)R、T均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,中心原子杂化类型___________ (填“相同”或“不相同”)。
(4)已知高温下4QM→2Q2M+M2,从Q原子价层电子结构的角度分析,能生成Q2M的原因是___________ 。
(5)已知AlY3通常以二聚体(Al2Y6)形式存在,画出其二聚体的结构式___________ (标出配位键)。
(1)W的元素符号
(2)X与M形成的XM3分子的VSEPR模型是
(3)R、T均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,中心原子杂化类型
(4)已知高温下4QM→2Q2M+M2,从Q原子价层电子结构的角度分析,能生成Q2M的原因是
(5)已知AlY3通常以二聚体(Al2Y6)形式存在,画出其二聚体的结构式
您最近一年使用:0次
7 . A、B、C、D、E是前四周期的五种元素,原子序数依次增大,只有B、C位于同一周期且位置相邻,其中C是地壳中含量最多的元素,D是其所处周期中电负性最强的元素,E为过渡元素,原子核外只有两个单电子,其余原子轨道均充满电子。回答下列问题
(1)B元素的基态原子电子的空间运动状态有_______ 种;E元素的价电子排布式_______ ,其基态原子有_______ 种能量不同的电子。
(2)B、C两种元素分别与A元素形成的两种10电子阳离子中,中心原子的杂化方式都是采用_______ 杂化,键角大的是_______ (填离子符号),原因是_______ 。
(3)D单质通入 中发生反应的离子方程式是
中发生反应的离子方程式是_______ :写出ADC的电子式_______ 。
(4) 的空间构型是
的空间构型是_______ ;第一电离能B_______ C(填“<”或“>”)。A、B、C三种元素电负性由大到小的顺序是_______ (用元素符号表示)。
(1)B元素的基态原子电子的空间运动状态有
(2)B、C两种元素分别与A元素形成的两种10电子阳离子中,中心原子的杂化方式都是采用
(3)D单质通入
 中发生反应的离子方程式是
中发生反应的离子方程式是(4)
 的空间构型是
的空间构型是
您最近一年使用:0次
8 . 如表为四种短周期元素的相关信息
回答下列问题(注:涉及元素的均要用对应元素的元素符号书写作答)
(1)Y元素的最简单氢化物的空间构型是___ 。
(2)Z、Q、R相比,其原子半径由大到小的顺序是___ 。
(3)最高价的R与Z元素组成的化合物中R原子的杂化方式为___ ,其中R在周期表中的位置是__ ,R的基态原子电子排布式为___ 。
(4)与O3分子互为等电子体的一种分子为___ ,阴离子为__ 。
(5)Y与R相比,非金属性较强的是___ ,能证明这一结论的事实是___ 。(用化学方程式表示)
| 元素 | 元素的相关信息 |
| Y | 原子最外层电子数是次外层电子数的2倍 |
| Z | 地壳中含量最多的元素 |
| Q | 短周期中金属性最强 |
| R | 常温下,R的单质是淡黄色固体,常在火山喷口附近沉积 |
(1)Y元素的最简单氢化物的空间构型是
(2)Z、Q、R相比,其原子半径由大到小的顺序是
(3)最高价的R与Z元素组成的化合物中R原子的杂化方式为
(4)与O3分子互为等电子体的一种分子为
(5)Y与R相比,非金属性较强的是
您最近一年使用:0次
9 . 四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4∶1,其d轨道中的电子数与最外层电子数之比为5∶1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是___________ 、___________ ;杂化轨道分别是___________ 、___________ ;a分子的立体结构是___________ 。
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是___________ 晶体,___________ 晶体。
(3)Y与Z比较,电负性较大的___________ 。
(4)W元素的化学式为___________ ,其+2价离子的核外电子排布式是___________ 。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是
(3)Y与Z比较,电负性较大的
(4)W元素的化学式为
您最近一年使用:0次
解题方法
10 . 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如图所示。

①在1个晶胞中,X离子的数目为___________ 。
②该化合物的化学式为___________ 。
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是___________ 。H2Y分子的立体构型为___________ 。
(3)Y与Z可形成YZ ,YZ
,YZ 的立体构型为
的立体构型为___________ (用文字描述)。
(1)X与Y所形成化合物晶体的晶胞如图所示。

①在1个晶胞中,X离子的数目为
②该化合物的化学式为
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是
(3)Y与Z可形成YZ
 ,YZ
,YZ 的立体构型为
的立体构型为
您最近一年使用:0次



